Сплайсосома
Сплайсосома — бұл негізінен эукариоттық жасушалардың ядросында орналасқан үлкен рибонуклеопротеидтік (RNP) кешені. Спликеосома шағын ядролық РНҚ -дан (snRNA) және көптеген ақуыздардан жинақталған. Кішкентай ядролық РНҚ (snRNA) молекулалары арнайы ақуыздармен байланысып, шағын ядролық рибонуклеопротеиндік кешен түзеді, ол өз кезегінде басқа snRNP-лермен қосылып, спликеосома деп аталатын үлкен рибонуклеопротеин кешенін құрайды. Сплайсосома біріншілік транскрипт түрі болып табылатын транскрипцияланған пре-мРНҚ- дан интрондарды жояды. Бұл процесс әдетте сплайсинг деп аталады.[1] Аналогия – бастапқы фильмнен сәйкес емес немесе дұрыс емес материалды (интрондарға эквивалентті) таңдап алып, тазартылған нұсқасын соңғы кесу үшін режиссерге жіберетін фильм редакторы.
Дегенмен, кейде интрондағы РНҚ сплайцеосома немесе ақуыз ферменттерін қолданбай-ақ, рибозима ретінде әрекет етеді.

Тарих[өңдеу | қайнарын өңдеу]
1977 жылы Шарп пен Робертс зертханаларының жұмысы жоғары сатыдағы ағзалардың гендерінің ДНҚ молекуласы бойында бірнеше бөлек сегменттерде «бөлінетінін» немесе болатынын анықтады.[2][3] Геннің кодтау аймақтары белок экспрессиясына қатыспайтын кодталмаған ДНҚ арқылы бөлінген. Бөлінген геннің құрылымы аденовирустық мРНҚ-лар бір тізбекті вирустық ДНҚ-ның эндонуклеазалық ыдырау фрагменттеріне гибридтелген кезде табылды.[2] мРНҚ-ДНҚ гибридтерінің мРНҚ-ларында сутегімен байланыспаған аймақтардың 5' және 3' құйрықтары бар екені байқалды. Вирустық ДНҚ-ның үлкенірек фрагменттері пайдаланылған кезде, вирустық мРНҚ-ға будандастырылған кезде ілмекті ДНҚ-ның айыр құрылымдары байқалды. «Сплайсинг» деп аталатын Sharp процесінде ілмектелген аймақтар, интрондар прекурсорлық мРНҚ-дан алынып тасталатыны анықталды. Бөлінген ген құрылымы кейіннен эукариоттық гендердің көпшілігіне тән екені анықталды. Филлип Шарп пен Ричард Дж. Робертс интрондар мен сплайсинг процесін ашқаны үшін физиология немесе медицина бойынша 1993 жылғы Нобель сыйлығымен марапатталды.
Құрамы[өңдеу | қайнарын өңдеу]
Әрбір сплайсосома бес шағын ядролық РНҚ -дан (snRNA) және байланысты ақуыз факторларының ауқымынан тұрады. Бұл кішігірім РНҚ-лар белок факторларымен біріктірілгенде, олар snRNP деп аталатын РНҚ-белок кешендерін жасайды (s mall n nuclear r ibo n ucleo p ротеиндер, айтылады «snurps»). Негізгі сплайсосоманы құрайтын snRNA-лар U1, U2, U4, U5 және U6 деп аталады, себебі олар уридинге бай және бірнеше РНҚ-РНҚ және РНҚ-ақуыз әрекеттесуге қатысады.[1]
Сплайсосоманың жиналуы әрбір пре-мРНҚ-да (гетерогенді ядролық РНҚ, hn-РНҚ деп те аталады) әрбір экзон:интрондық түйіспеде жүреді. Пре-мРНҚ интрондарында сплайцеосоманы құрастыру кезінде танылатын және пайдаланылатын белгілі бір реттілік элементтері бар. Оларға 5' соңы қосылыс орны, тармақтық нүкте тізбегі, полипиримидиндік жол және 3' соңы қосылу орны жатады. Сплайсеосома интрондардың жойылуын және бүйірлік экзондардың байлануын катализдейді.
Интрондарда әдетте 5' соңындағы қосылыс орнында GU нуклеотидтер тізбегі және 3' соңындағы қосылыс орнында AG болады. 3' қосылатын жерді полипиримидиндік жол (PPT) деп аталатын полипиримидиндердің өзгермелі ұзындығы арқылы анықтауға болады, ол 3' қосылу орнына факторларды тартудың қосарлы функциясын және мүмкін тармақтық нүкте тізбегіне (BPS) тарту факторларын қызмет етеді. BPS құрамында сплайсингтің бірінші қадамы үшін қажетті консервіленген аденозин бар.
Көптеген ақуыздар мырышпен байланыстыру мотивін көрсетеді, бұл сплайс механизміндегі мырыштың маңыздылығын көрсетеді.[4][5][6] U4/U6 бірінші молекулалық реконструкция. U5 үштік шағын ядролық рибонуклеопротеин (tri-snRNP) кешені 2016 жылы хабарланды.[7]
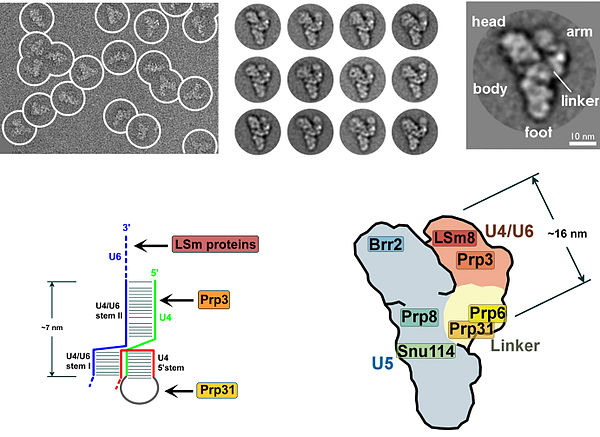
Cryo-EM Ши және т.б. ашытқылардағы[9] және адамдардағы спликосоманың жақын/атомдық құрылымын түсіндіру.[10] Атомға жақын ажыратымдылықтағы сплайсосоманың молекулалық құрылымы U5 snRNP-нің Spp42 компонентінің орталық тіректерді құрайтынын және ашытқыдағы каталитикалық орталықты бекітетінін көрсетеді. Адам сплайсеосомасының атомдық құрылымы II қадамды көрсетеді Slu7 құрамдас бөлігі 3'-қосылу орнын таңдауға дайын кеңейтілген құрылымды қабылдайды. Ашытқылар кешеніндегі барлық бес металдар (Mg2+ ретінде тағайындалған) адам кешенінде сақталады.
Альтернативті сплайсингу[өңдеу | қайнарын өңдеу]
Альтернативті сплайсинг (әртүрлі экзондардың қайта қосылуы) эукариоттардың генетикалық әртүрлілігінің негізгі көзі болып табылады. Сплайс нұсқалары адам геномындағы ақуызды кодтайтын гендердің салыстырмалы түрде аз санын есепке алу үшін пайдаланылды, қазіргі уақытта шамамен 20 000 деп бағаланады. Дрозофиланың бір гені, Dscam, оның барлық экзондары бір-бірінен тәуелсіз қосыла алады деп есептей отырып, 38 000 түрлі мРНҚ -ға баламалы түрде біріктірілген деп болжалды.[11]
Синтез[өңдеу | қайнарын өңдеу]
Сплайсосоманың белсенді аймағын қалыптастыру үлгісі пре-мРНҚ субстратында дискретті snRNP бөлшектерінің реттелген, сатылы жиналуын қамтиды. Пре-мРНҚ-ларды бірінші тану U1 snRNP пре-мРНҚ-ның 5' соңғы қосылыс орнына және басқа да snRNP-мен байланысты емес факторларға міндеттеме кешенін немесе сүтқоректілерде ерте (E) кешенін құруды қамтиды.[12][13] Міндеттеме кешені пре-мРНҚ-ны сплайсинг жолына бекітетін ATP-тәуелсіз кешен болып табылады.[14] U2 snRNP U2AF (U2 snRNP көмекші факторы) және мүмкін U1 snRNP E кешенді компонентімен өзара әрекеттесу арқылы салалық аймаққа тартылады. ATP-тәуелді реакцияда U2 snRNP тармақтық нүкте тізбегімен (BPS) тығыз байланысып, А кешенін түзеді. U2 snRNP мен mRNA-ға дейінгі тармақтық аймақ арасында түзілген дуплекс аденозин тармағын шығарып, оны нуклеофил ретінде көрсетеді. бірінші трансэтерификация.[15]
U2 snRNA-да псевдоуридин қалдығының болуы, тармақталу орнына дерлік қарама-қарсы, U2 snRNP байланысу кезінде РНҚ-РНҚ дуплексінің өзгерген конформациясына әкеледі. Нақтырақ айтқанда, псевдуридинмен индукцияланған дуплекстің өзгерген құрылымы дөңес аденозиннің 2' OH-ын сплайсингтің бірінші қадамы үшін қолайлы жағдайға қояды.[16] U4/U5/U6 tri-snRNP (1-суретті қараңыз) В комплексін қалыптастыру үшін жинақтаушы сплайцеосомаға тартылады және бірнеше қайта құрылымдаудан кейін катализ үшін С кешені белсендіріледі.[17] Tri-snRNP А кешеніне қалай тартылатыны белгісіз, бірақ бұл процесс U2 snRNA және U6 snRNA арасындағы ақуыз-белок әрекеттесуі және/немесе негізді жұптастыру әрекеттесуі арқылы жүзеге асырылуы мүмкін.
U5 snRNP U5 snRNA[18] инвариантты ілмегі арқылы 5' және 3' қосылу орындарындағы тізбектермен өзара әрекеттеседі және U5 ақуыз компоненттері 3' қосылатын жер аймағымен әрекеттеседі.[19]
Tri-snRNP жинақталғаннан кейін бірінші каталитикалық қадамның алдында бірнеше РНҚ-РНҚ қайта түзілулері жүреді және каталитикалық белсенді сплайцеосомада одан әрі қайта құрылымдау орын алады. РНҚ-РНҚ өзара әрекеттесулерінің бірнешеуі бірін-бірі жоққа шығарады; дегенмен, бұл өзара әрекеттесулерді не тудыратыны және бұл қайта реттеулердің реті белгісіз. Бірінші қайта құрылымдау, мүмкін, U1 snRNP -нің 5' қосылатын жерінен ығысуы және U6 snRNA әрекеттесуінің қалыптасуы. U1 snRNP толық қалыптасқан сплайцеосомалармен әлсіз ғана байланысты екені белгілі,[20] және U1 snRNP құрамында қысқа 5' экзон және 5' бар субстрат олигонуклеотидінің үлгісінде U6-5' қосылыс орнының әрекеттесуін тежейді. жалғау орны.[21] U2 snRNP-нің тармақтық нүкте тізбегіне (BPS) қосылуы ақуыз-РНҚ өзара әрекеттесуін ығыстыратын РНҚ-РНҚ өзара әрекеттесуінің бір мысалы болып табылады. U2 snRNP тартылған кезде міндеттеме кешеніндегі SF1 тармақты байланыстыратын ақуыз орын ауыстырады, өйткені U2 snRNA және SF1 байланысу орны бір-бірін жоққа шығаратын оқиғалар болып табылады.
U2 snRNA ішінде бәсекелес конформациялар арасында пайда болатын басқа да бір-бірін жоққа шығаратын қайта құрулар бар. Мысалы, белсенді түрде IIa діңгек ілмегі қолайлы; белсенді емес формада цикл мен төменгі ағын тізбегі арасындағы өзара эксклюзивті өзара әрекеттесу басым болады.[17] U4-тің U6 snRNA-дан қалай ығысатыны түсініксіз, дегенмен РНҚ сплайцеосома жинақталуына қатысы бар және U4/U6-ны босатып, U2/U6 snRNA өзара әрекеттесуінің қалыптасуына ықпал етуі мүмкін. U4/U6 өзек ілмектерінің I және II өзара әрекеттесулері диссоциацияланады және U6-ның босатылған діңгек ілмегі II аймағы молекулаішілік діңгек ілмегін құру үшін өзіне бүктеледі және U4 бұдан әрі сплайцеосома жинақтауында қажет емес. U6 негізінің босатылған I ілмек аймағы U2/U6 I спиральын құрайтын U2 snRNA-мен жұптасады. Дегенмен, I спираль құрылымы U2 snRNA-ның ішкі 5' діңгек ілмегі аймағының 3' жартысымен өзара ерекшеленеді.
Кіші сплайсосома[өңдеу | қайнарын өңдеу]
Кейбір эукариоттарда кіші сплайсосома деп аталатын екінші сплайсосома болады.[22] Азырақ snRNAs тобы, U11, U12, U4atac және U6atac, U5-пен бірге, U12-типімен белгіленетін, мРНҚ-ға дейінгі интрондардың сирек класын біріктіретін кіші сплайцеосоманың қосалқы бөліктері болып табылады. Кіші сплайсосома негізгі аналогы сияқты ядрода орналасқан,[23] дегенмен кейбір мамандандырылған жасушаларда, соның ішінде ануклеат тромбоциттер[24] және нейрондық жасушалардың дендроплазмасы (дендрит цитоплазмасы) бар.[25]
Дереккөздер[өңдеу | қайнарын өңдеу]
- ↑ a b "Spliceosome structure and function". Cold Spring Harbor Perspectives in Biology 3 (7): a003707. July 2011. doi:10.1101/cshperspect.a003707. PMC 3119917. PMID 21441581. Дереккөз қатесі: Invalid
<ref>tag; name "Spliceosome_review_2011" defined multiple times with different content - ↑ a b "Spliced segments at the 5' terminus of adenovirus 2 late mRNA". Proceedings of the National Academy of Sciences of the United States of America 74 (8): 3171–5. August 1977. Bibcode 1977PNAS...74.3171B. doi:10.1073/pnas.74.8.3171. PMC 431482. PMID 269380.
- ↑ "A map of cytoplasmic RNA transcripts from lytic adenovirus type 2, determined by electron microscopy of RNA:DNA hybrids". Cell 11 (4): 819–36. August 1977. doi:10.1016/0092-8674(77)90294-X. PMID 890740.
- ↑ "Semiquantitative proteomic analysis of the human spliceosome via a novel two-dimensional gel electrophoresis method". Molecular and Cellular Biology 31 (13): 2667–82. July 2011. doi:10.1128/mcb.05266-11. PMC 3133382. PMID 21536652.
- ↑ "Stalling of spliceosome assembly at distinct stages by small-molecule inhibitors of protein acetylation and deacetylation". RNA 15 (1): 153–75. January 2009. doi:10.1261/rna.1332609. PMC 2612777. PMID 19029308.
- ↑ "Molecular architecture of zinc chelating small molecules that inhibit spliceosome assembly at an early stage". RNA 18 (9): 1605–11. September 2012. doi:10.1261/rna.034819.112. PMC 3425776. PMID 22832025.
- ↑ "STRUCTURE. A Big Bang in spliceosome structural biology". Science 351 (6280): 1390–2. March 2016. doi:10.1126/science.aaf4465. PMID 27013712.
- ↑ "Localization of Prp8, Brr2, Snu114 and U4/U6 proteins in the yeast tri-snRNP by electron microscopy". Nature Structural & Molecular Biology 15 (11): 1206–12. November 2008. doi:10.1038/nsmb.1506. PMID 18953335.
- ↑ "Structure of a yeast spliceosome at 3.6-angstrom resolution". Science 349 (6253): 1182–91. September 2015. doi:10.1126/science.aac7629. PMID 26292707.
- ↑ "An Atomic Structure of the Human Spliceosome". Cell 169 (5): 918–929.e14. May 2017. doi:10.1016/j.cell.2017.04.033. PMID 28502770.
- ↑ "Drosophila Dscam is an axon guidance receptor exhibiting extraordinary molecular diversity". Cell 101 (6): 671–84. June 2000. doi:10.1016/S0092-8674(00)80878-8. PMID 10892653.
- ↑ "The spliceosome assembly pathway in mammalian extracts". Molecular and Cellular Biology 12 (10): 4279–87. October 1992. doi:10.1128/MCB.12.10.4279. PMC 360351. PMID 1383687.
- ↑ "Identification of functional U1 snRNA-pre-mRNA complexes committed to spliceosome assembly and splicing". Cell 59 (2): 349–58. October 1989. doi:10.1016/0092-8674(89)90296-1. PMID 2529976.
- ↑ "Early commitment of yeast pre-mRNA to the spliceosome pathway". Molecular and Cellular Biology 8 (9): 3755–60. September 1988. doi:10.1128/MCB.8.9.3755. PMC 365433. PMID 3065622.
- ↑ "Branch nucleophile selection in pre-mRNA splicing: evidence for the bulged duplex model". Genes & Development 8 (5): 587–97. March 1994. doi:10.1101/gad.8.5.587. PMID 7926752.
- ↑ "Sculpting of the spliceosomal branch site recognition motif by a conserved pseudouridine". Nature Structural Biology 9 (12): 958–65. December 2002. doi:10.1038/nsb873. PMID 12426583.
- ↑ a b "Mechanical devices of the spliceosome: motors, clocks, springs, and things". Cell 92 (3): 315–26. February 1998. doi:10.1016/S0092-8674(00)80925-3. PMID 9476892. Дереккөз қатесі: Invalid
<ref>tag; name "pmid9476892" defined multiple times with different content - ↑ "snRNA interactions at 5' and 3' splice sites monitored by photoactivated crosslinking in yeast spliceosomes". RNA 1 (9): 968–80. November 1995. PMC 1369345. PMID 8548661. http://www.rnajournal.org/cgi/reprint/1/9/968.
- ↑ "Evidence that U5 snRNP recognizes the 3' splice site for catalytic step II in mammals". The EMBO Journal 16 (15): 4746–59. August 1997. PMC 1170101. PMID 9303319.
- ↑ "Evidence for two active sites in the spliceosome provided by stereochemistry of pre-mRNA splicing". Nature 365 (6444): 364–8. September 1993. Bibcode 1993Natur.365..364M. doi:10.1038/365364a0. PMID 8397340.
- ↑ "Disruption of base pairing between the 5' splice site and the 5' end of U1 snRNA is required for spliceosome assembly". Cell 75 (5): 863–73. December 1993. doi:10.1016/0092-8674(93)90531-T. PMID 8252623.
- ↑ "Splicing double: insights from the second spliceosome". Nature Reviews. Molecular Cell Biology 4 (12): 960–70. December 2003. doi:10.1038/nrm1259. PMID 14685174.
- ↑ "Minor spliceosome components are predominantly localized in the nucleus". Proceedings of the National Academy of Sciences of the United States of America 105 (25): 8655–60. June 2008. doi:10.1073/pnas.0803646105. PMID 18559850.
- ↑ "Escaping the nuclear confines: signal-dependent pre-mRNA splicing in anucleate platelets". Cell 122 (3): 379–91. August 2005. doi:10.1016/j.cell.2005.06.015. PMID 16096058.
- ↑ "RNA splicing capability of live neuronal dendrites". Proceedings of the National Academy of Sciences of the United States of America 102 (46): 16859–64. November 2005. doi:10.1073/pnas.0503783102. PMID 16275927.
Сыртқы сілтемелер[өңдеу | қайнарын өңдеу]
| ||||||||||||||||||||||