Химиялық байланыстар
Химиялық байланыстар — химиялық элементтер арасындағы тұрақты тепе-тең күйдегі жүйе жасауға келіп тірелетін (молекула, ион, радикал) электромагниттік әсерлесу жиынтығы.[1][2]
Жалпы мәліметтер
[өңдеу | қайнарын өңдеу]Химиялық байланыс — атомдардың химиялық қосылыс түзіп әрекеттесуі.
- 19 - ғасырдың басында К.Бертолле химиялық байланыс түзілуінің гравитациялық,
- 1810 жылы Й.Я Берцелиус электрохимиялық,
- 1861 жылы орыс ғалымы А.Н Бутлеров заттардың химиялық құрылыс теориясын,
- 1915 жылы неміс физигі Кассель,
- 1916 жылы ағылшын ғалымы Г.Льюис электрондық теорияларын ұсынды.
Кванттық механика көзқарасы тұрғысынан химиялық байланыс валенттілік сұлба және молекулалық орбиталдар әдісімен түсіндіріледі. Химиялық байланыс түзілуіне қарай төртке бөлінеді:
- иондық
- коваленттік
- металдық
- сутектік
Иондық химиялық байланыс электр терістілігі бойынша айырмашылығы үлкен металл мен бейметалл атомдары арасында түзіледі. Химиялық әрекеттескенде валенттік электрондарын беріп, оң зарядты иондарға (катиондарға): К־–е–К+ бейметалл атомдары электрондар қосып алып, теріс зарядты иондарға (аниондарға) айналады: Cl+е–Cl־. Әр аттас зарядты иондар бірін-бірі тартып молекула құрайды: K+ + Cl ־= KCl. Иондық Химиялық байланыс қарама-қарсы зарядталған иондардың электрстатикалық тартылысы нәтижесінде жүзеге асады. Иондар түзілу арқылы жүзеге асатын байланыстарды иондық байланыс, қосылыстың өзін иондық қосылыс деп атайды. Иондық қосылыстардың қайнау, балқу температурасы жоғары, қызуға тұрақты, олар полюстік еріткіштерде тез ериді, ерітінділері электр тогын жақсы өткізеді.
Коваленттік химиялық байланыста әрекеттесуші атомдарға ортақ электрондар жұбы пайда болып, олардың санына қарай бір немесе бірнеше еселенген байланыстар түзіледі. Мысалы, сутек молекуласында атомдары арасында бір (Н:Н), оттек молекуласында екі (:О::О:), азот молекуласында үш (:N:::N:) еселенген ковалентті химиялық байланыстар бар. Яғни коваленттік байланыс байланыс түзетін атомдар арасында ортақ электрон бұлтының түзілуінен пайда болады. Бұл теорияны Г.Н. Льюис 1916 ж. ұсынған. Ортақ электрон бұлтының түзілуінің екі тәсілі бар: 1. Әрбір атомның сыртқы валенттік электрондарының электрон бұлттарының қабысуы арқылы; 2. Бір атомның дайын электрон жұбы екінші атомның бос орбиталіне көшіп орналасуы арқылы. Коваленттік химиялық байланыстар электрон жұбының атомдардың арасында орналасуына қарай полюсті және полюссіз деп екіге бөлінеді.
Полюсті молекулада химиялық байланыс түзетін ортақ электрондар электр терістілігі күшті атомға қарай ығыса орналасады. Коваленттік полюсті байланыс электр терістілігінің (ЭТ) айырмашылығы бар бейметалдар арасында түзіледі. Молекула полярланады (полюстенеді). Мысалы, судың молекуласы - диполь. Молекуланың полюстілігі диполь моменті арқылы көрсетіледі. Полюстік молекулалардың қайнау және балқу температурасы төмен, полюсті еріткіштерде үйектеліп иондарға ыдырайды.Иондық байланысты коваленттік полюстік байланыстың шегіне жеткен түрі деп қарастыруға болады.
Полюссіз ковалентті химиялық байланысты молекулада электрон жұбы атомға ауыспай, симметриялы түрде ортада орналасқан. Полюссіз ковалентті байланыс - бейметалл атомдарынан тұратын жай заттардың молекуласында кездесетін байланыс. Мысалы, оттек (О2), сутек (Н2), азот (N2), хлор (СІ2) т.б. Полюссіз химиялық байланыстағы қосылыстардың қайнау және балқу температуралары төмен, полюсті еріткіштерде иондар түзбейді, электр тоғын өткізбейді. Бөлінбеген электрон жұбы мен электронсыз бос орбиталі бар атомдардан донорлық-акцепторлық механизм бойынша коваленттік байланыс түзіледі. Мысалы, аммоний катионы мен гидроксоний ионының түзілуі. Осындай механизм бойынша түзілген химиялық байланыстар координациялық байланыс деп те аталады. Сутектік химиялық байланыс — екі молекуладағы немесе бір молекуладағы атомдар арасында сутек атомының оң заряды арқылы түзіледі. Ол молекула аралық және молекула ішілік сутектік байланыс деп жіктеледі.
Металдық химиялық байланыс — металл атомдарының сыртқы қабатындағы бос электрондар қатысуымен түзілетін байланыс. Химиялық байланыстар сыртқы валенттік электрондар арқылы жүзеге асады.
Химиялық байланысының негізгі сипаттамалары (коваленттік байланыстардың сипаттамалары):
- байланыс энергиясы,
- байланыс ұзындығы,
- валенттік бұрыш,
- байланыстың бағытталуы.
Байланыс энергиясы — өзара байланысқан атомдарды не иондарды бір-бірінен ажырату үшін жұмсалатын энергия. Байланыс ұзындығы — химиялық байланыстағы атомдар ядроларының арасындағы қашықтық, валенттік бұрыш — байланысқан атомдар ядролары арқылы жүргізілетін жорамал сызықтар арасындағы бұрыш. Бұл көрсеткіштер зат молекуласының құрылысын, пішінін және беріктігін сипаттайды.
Химиялық байланыстардың түрлері
[өңдеу | қайнарын өңдеу]Химиялық байланыс түзілген кезде әрекеттесуші атомдардың сыртқы электрондық қабаттарында өзгерістер жүреді. Байланыстың төрт түрі болады.
Ковалентті байланыс
[өңдеу | қайнарын өңдеу]Ковалентті байланыс екі бейметалл атом арасында ортақтасқан электрондары болатын байланыс түрі. Химиялық байланыстың түзілуін электртерістілік ұғымын қолданып түсіндіруге болады.
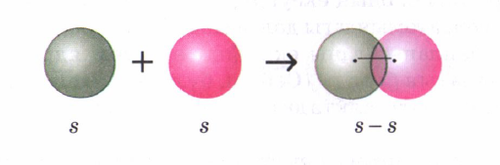
Электртерістіліктері бірдей элемент атомдарының арасында (Н2, О2, N2, С12) байланыста болатын сутек молекуласының түзілу мысалында қарастырайык. Сутек атомының электрондық формуласы 1s1. Сутектің электротерістілігі 2,1. S-электрондарының электрон бұлттары сфера (шар) тәрізді, олардың өзара әсерлесуін былай көрсетуге болады:
Cонда s электрондарының бұлттары өзара қабысып, екі электрон екі ядроға да ортақ, олардан бірдей қашықтықта орналасады. Бірдей атомдардың арасындағы байланыс полюссіз ковалентті байланыс деп аталады. Электрон бұлттары қабысуы нәтижесінде энергия бөлініп, молекула түзіледі. Бұл энергия шамасы молекуладағы байланыс беріктілігін сипаттайды, олай болса молекула жеке атомдарға қарағанда тұрақты жүйе болғаны.
Полюссіз ковалентті байланыста байланыстырушы электрон жұбының бұлты ядролардан бірдей қашықтықта орналасады.
Молекулалардың құрылымдық формулаларында бір электрон жұбына бір сызықшаға ( - ) сейкес келеді. Сутек атомдарының валенттіліктері I, себебі валенттілік байланыс түзуге жұмсалған электрондар санымен анықталады. Сутегі молекуласындағы элементтердің тотығу дәрежелері нөлге тең, себебі атомдардың электртерістіліктері бірдей, электрондар жұптары екі элемент ядросынан бірдей қашықтықта орналасады.
Енді оттегі молекуласындағы байланыстың түзілуін қарастырайық.
Оттек атомының электрондық формуласы 1s22s22p4, валенттілік электрондары 2s22p4, электртерістілігі 3,5.
Электронды-графикалық формуласын қарасақ, валенттілік электрондар саны 6, оның екеуі дара күйінде, міне, осы электрондар екінші оттек атомындағы дәл осындай электрондармен екі жұп түзеді, яғни байланыс саны екі. Енді әр атом ядросын 8 электроннан айналатын болады. Сөйтіп, бұл мысалдан да көретініміз молекула түзілгенде аяқталған 8 электронды қабаттың пайда болуы.
Оттек атомдарының тотығу дәрежелері нөлге тең, валенттіліктері ІІ-ге тең болады. Еселі байланыс дара байланысқа қарағанда беріктеу болады.
Электрондардың электрон бұлттарының формаларын қолданып байланыстың түзілуін көрсетсек:
σ - байланыс дегеніміз электрон бұлттарының қабысу ауданы ядролардың қосылу сызығының бойында жатқанда түзілетін байланыс (а).
Ал π - байланыс — электрон бұлттарының қабысу ауданы ядроларды қосатын сызықтың екі жағында орналасқанда түзіледі (ә).
Оттегі молекуласында атомдар бір-бірімен қос байланыспен байланысқан, оның бірі – σ болса, екіншісінің π- байланыс екендігін байқайсыңдар.
Олай болса, π- байланыс тек еселік байланыстарда болса, σ- байланыс дара байланыс кезінде түзіледі. Атомдар арасындағы дара байланыстардың барлығы σ- байланыстар, қос байланыстың біреуі – σ- байланыс, екіншісі π- байланыс; ал үш байланыстың біреуі – σ- байланыс, қалған екеуі π- байланыстар болады.
Полюсті коваленттік байланыс дегеніміз байланыстырушы электрон жұбының бұлты электртерістігі басым элемент атомына қарай ығыса орналасқан байланыс.[3]
Сутектік байланыс
[өңдеу | қайнарын өңдеу]Сутектік байланыс оң зарядты полюстікке ие болған сутек атомы мен теріс полюсті, электртерістігі күшті, бөлінбеген электрон жұбы бар (көбіне F, О, N, кейде CI, S) атомдар арасында түзіледі. Сондықтан сутектік байланыстың механизмін жартылай электростатикалық, жартылай донорлы-акцепторлы деп қарастыруға болады.
Сутектік байланысқа ақуыздардағы карбонил тобы мен амин тобындағы сутектің арасында түзілген байланыс мысал бола алады.
Бұл полинуклеотидтер молекуласында іске асатын молекулаішілік сутектік байланысқа жатады. Ақуыздардың екіншілік (спиральдік) құрылысы молекулаішілік сутектік байланыстардың нәтижесінде жүзеге асады. Ал химияда көбіне молекулааралық сутектік байланыстар кездеседі. Оны этил спиртінің өзінен немесе оны суға араластырғанда жылу бөле жүретін үрдістен байқауға болады. Сутектік байланыс, байланыстың басқа түрлеріне қарағанда, әлсіз байланыс болып саналады, оны байланыс энергиясынан көруге болады.
Кіші молекулалы су, спирт, альдегид тәрізді заттардың қалыпты жағдайда сұйық күйде болуы - сутектік байланыстың әсерінен. Сонымен қатар, аммиак, фторсутек сияқты газ күйіндегі заттардың оңай сұйылуы олардың молекуласының арасында түзілетін сутектік байланыстар арқылы іске асырылады.
Сутектік байланыспен байланысқан заттар молекулалық кристалдық торға ие болады.
Иондық байланыс
[өңдеу | қайнарын өңдеу]Иондық байланыс катиондар мен аниондардың арасында электро-статикалық тартылу күшінің нәтижесінде пайда болады. Химиялық әрекеттескен атомдар 8 электронды тұрақты октет қабатқа ие болып, катион мен анионға айналу үшін олар күшті металдар мен бейметалдарға жатуы тиіс.
Иондық байланысқан қатты заттар иондық кристалдық торға ие болады. Сондықтан олар қатты, берік, қиын балқитын заттарға жатады. Иондық байланыс көбіне нағыз типтік металдардың оксидтері мен гидроксидтеріне және барлық тұздарға тән.
Әдетте, бір молекуланың ішінде байланыстың әр түрлі типтері кездеседі. Мысалы, күшті негіздерде (КОН, Са(ОН)2, т.б. ) металл катионы мен гидроксотоп арасында иондық, ал оттек пен сутек арасында коваленттік полюсті байланыс түзіледі. Оттекті қышқылдардың тұздарында да (K2SО4, СаСО3, т.б.) металл катионы қышқыл қалдығының анионымен иондық байланыспен байланысса, оттек пен бейметалл (С, S) арасында коваленттік полюсті байланыс түзіледі.
Жалпы алғанда, химиялық байланысты типтерге жіктеу шартты сипатқа ие. Өйткені олардың түпкі негізі бір. Мысалы, иондық байланысты коваленттік байланыстың шекті түрі деп қарау керек. Металдық байланыста коваленттік полюсті байланыстың да, иондық байланыстың да элементтері бар. Көптеген заттарда "таза" бір ғана химиялық байланыс типі бола бермейді. Мысалы, ас тұзы — натрий хлориді иондық байланысты қосылыстарға жатады. Іс жүзінде оның 84% байланысы иондыққа, қалған 16%-і коваленттіге тиесілі. Сондықтан химиялық байланыстың полюстік дәрежесін біліп тұрып, нақты қай типке жататынын сөз еткен дұрыс.
Егер галогенсутектер қатарындағы байланыстың полюстік дәрежесінің өзгеруіне келсек, фторсутектен астатсутекке қарай: HF→HCl→HBr→HI→HAt төмендейді. Себебі галоген мен сутектің электртерістіктерінің айырмашылығы азая түседі де, ақыры астатсутекке жеткенде байланыс полюссіз коваленттіге жуықтайды.
Химиялық байланыстың барлық типтері мен түрлерінің негізі бір болатыны — олардың бәрінің де табиғаты электрондық бұлттардың тығыздығының өзгеруіне тәуелді. Химиялық байланыстың түзілуі кез келген жағдайда электрондық-ядролық әрекеттесудің арқасында, осы кездегі энергия ұтысының (бөлінуінің) нәтижесінде іске асады. Оны барлық химиялық байланыс типтерінің белгілерін өзара салыстырғанда байқаймыз.[4]
Металдық байланыс
[өңдеу | қайнарын өңдеу]Металдың кристалдық торының түйіндерінде атомдар немесе олардың иондары орналасатыны белгілі. Металдық тордағы бостау күйдегі делокальданған электрондар көптеген ядролардың арасында өзара тарту күштерін тудырып, металдық байланыс түзеді. Металдардың сыртқы деңгейіндегі валенттік электрондар саны аз болатындықтан, олардың иондарға айналуы қиын емес: Me - ne- → Ме+n
Мұндай қабілетті металдар бос күйде де, химиялық әрекеттесу кезінде де көрсетеді. Бос күйдегі металдың белгілі физикалық қасиеттері: электр- және жылуөткізгіштігі, қаттылығы, иілімділігі, созылғыштығы, өзіне тән жылтыры, т.б. булардың барлығы металдық байланысқа тәуелді.
Металдардың валенттік электрондары өз ядросымен нашар байланысқан. Сондықтан, бір-бірінен оңай ажырайды және металда теріс иондар қатары қалыптасады. Бұл иондар кристалдық торда орналасқан және электрондардың көбісі бүкіл кристалл бойынша жылжи алады. Металдың электрондары бүкіл металдағы атомдарды байланыстырады. [5]
Металдағы электрондар (валенттік электрондар) газ бен кристалдық торлардағызарядталған иондардың арқаумен бір-бірімен әрекеттесуіне себепші болған - химиялық байланыс. Металдық байланыстың идеалды моделі металдың валенттік электрондармен жарым-жартылай топтастырылған энергетикалық аймағының (өткізу қабілеті бар зонасы) пайда болуына сәйкес келеді. Металдарды құрастыратын атомдардың жақындасуымен валенттік электрондардың атомдық орбиталдары, түйіндес қоспаның делокализдалған p-орбиталдар сияқты, кристалдық торлар бойынша делокализдалған p-орбиталдарға айналады. Металдық байланыстыңсандық сипаттамасы квант механикасымен ғана бола алады. Сапалық сипаттаманы коваленттік байланыстың ұғымымен түсінуге болады.
Металдың екі атомы жақындасқанда, мысалы Li, коваленттік байланыс пайда болады, сонымен валенттік электрондың әр энергетивтік деңгейі екіге бөлінеді. Li атомдардың N саны кристалдық торларды жасаған кезде, көрші атомдардың электрон бұлттарының қайта жабуы валенттік электрондың әр энергетикалық деңгейі N деңгейлерге бөлінеді. Деңгейлердің саны көп болғандықтан, олар бір-біріне жақын орналасқан. Сол үшін оларды энергетикалық деңгейлердің бөлінбейтін, әрі ақырғы ені бар, бір зонасы деп есептеуге болады. Валенттік электронлардың саны бірдей болған екі атомдық молекуламен салыстырғанда, әр атом көп байланыстардың пайда болуына үлес қосып жатады. Сондықтан, жүйенің энергиясының минимумы (немесе байланыстың максимумы) молекуладағы екі центрлік байланысына қарағанда, үлкен қашықтыққа жете алады.
Металдардағы атомдар арасындағы қашықтық, коваленттік байланыспен құрылған қосылыстарға қарағанда (металдық атомдардың радиусы әрқашан коваленттік радиусынан үлкен) едәуір үлкен. Ал үйлестіретін саны (ең жақын көршілердің саны) металдың кристалдық торыларында көбінесе 8 немесе 8-ден үлкен. Ең көп кездесетін кристалдық құрылымдардың үйлестіретін саны 8 (көлеміцентрир. текше), 12 (шекцетрир. текше немесе гексаген. тығыздап оралған). Коваленттік радиустарды пайдаланып, металл торларының параметрлерінің есептеуі төмен нәтижелерді көрсетеді. Осылайша, Li2 молекуланың (коваленттік байланыс) Li атомдардың арасындағы қашықтығы 0,267 нм, ал Li металдың ішінде 0,304 нм тең. Металдағы әр Li атомдың ең жақын көршілерінің саны 8 болса, есе көп қашықтықта тағы 6 бар. Байланыстың энергиясы Li бір атомға санасақ, ең жақын көршілердің саны өскеннен Li2 үшін 0,96.10-19Дж-нен, кристалдық Li үшін 2,9.10-19 Дж-ге өседі.[6]
Дереккөздер
[өңдеу | қайнарын өңдеу]- ↑ Қазақ тілі терминдерінің салалық ғылыми түсіндірме сөздігі: Химия. Н.Нұрахметов, А.Ниязбаева, Р.Рысқалиева, Н.Далабаева. — Алматы: "Мектеп" баспасы, 2007. — 336 бет. ISBN 9965-36-416-8
- ↑ "Қазақ Энциклопедиясы", 9 том
- ↑ Химия: Жалпы білім беретін мектептің 8 сыныбына арналған оқулық. Усманова М.Б., Сақариянова Қ.Н. / Алматы: Атамұра, 2009. - 216 бет. ISBN 9965-34-887
- ↑ Химия: Жалпы білім беретін мектептің жаратылыстану-математика бағытындағы 11-сыныбына арналған оқулық / Ә. Темірболатова, Н. Нұрахметов, Р. Жұмаділова, С. Әлімжанова. – Алматы: «Мектеп» баспасы, 2007. – 352 бет, суретті. ISBN 9965-36-092-8
- ↑ Http://school-sector.relarn.ru/nsm/chemistry/Rus/Data/Text/Ch1_4.html#OLE_LINK5 Мұрағатталған 14 тамыздың 2018 жылы.
- ↑ http://www.xumuk.ru/encyklopedia/2533.html
| Бұл мақаланы Уикипедия сапа талаптарына лайықты болуы үшін уикилендіру қажет. |
| ||||||||||||||||||