Сигналдық трансдукция
Бұл мақала әлі тексерістен өтпеді. Тексерілмеген мақалалардағы мәліметтер сенімсіз болуы мүмкін.
|

Сигналдық трансдукция - химиялық немесе физикалық сигнал жасуша арқылы бірнеше молекулалық оқиғалар түрінде берілетін процесс, көбінесе ақуыз киназдары катализдейтін ақуыздың фосфорлануы, нәтижесінде жасуша реакциясы пайда болады. Ынталандыруды анықтауға жауап беретін ақуыздар әдетте рецепторлар деп аталады, Дегенмен кейбір жағдайларда "сенсор"термині қолданылады.[1] Рецептордағы лигандтың байлануынан (немесе сигналды қабылдаудан) туындаған өзгерістер биохимиялық каскадқа әкеледі, бұл сигнал жолы деп аталатын биохимиялық оқиғалардың тізбегі.
Сигнал беру жолдары бір-бірімен әрекеттескен кезде олар ұялы жауаптарды, көбінесе комбинаторлық сигнал беру оқиғаларымен үйлестіруге мүмкіндік беретін желілерді құрайды.[2] Молекулалық деңгейде мұндай реакцияларға гендердің транскрипциясының немесе трансляциясының өзгеруі және белоктардың трансляциядан кейінгі және конформациялық өзгерістері, сондай-ақ олардың орналасуының өзгеруі жатады. Бұл молекулалық оқиғалар жасушалардың өсуін, көбеюін, метаболизмін және басқа да көптеген процестерді бақылайтын негізгі механизмдер болып табылады.[3] Көпжасушалы организмдерде сигнал тарату жолдары жасушалық байланысты әртүрлі тәсілдермен реттейді.
Сигнал беру жолының әрбір компоненті (немесе түйіні) бастапқы ынталандыруға қатысты атқаратын рөліне сәйкес жіктеледі. Лигандалар бірінші хабаршылар деп аталады, ал рецепторлар сигнал түрлендіргіштері болып табылады, содан кейін бастапқы эффекторларды белсендіреді. Мұндай эффекторлар әдетте белоктар болып табылады және көбінесе екінші хабаршылармен байланысады, олар қайталама эффекторларды белсендіре алады және т.б. Түйіндердің тиімділігіне байланысты сигналды күшейтуге болады (сигналдың күшеюі деп аталатын тұжырымдама), осылайша бір сигналдық молекула жүздеген және миллиондаған молекулаларды қамтитын жауапты жасай алады.[4] Басқа сигналдар сияқты, биологиялық сигналдардың трансдукциясы кідіріспен, шуылмен, сигналдық кері байланыспен және елеусізден патологиялық деңгейге дейін өзгеруі мүмкін кері байланыспен және кедергімен сипатталады.[5] Есептеу биологиясының пайда болуымен сигнал беру жолдары мен желілерін талдау жасушалық функциялар мен ауруларды, соның ішінде алынған дәрілік төзімділікке жауаптардың негізінде жатқан сигналдық қайта қосу механизмдерін түсінудің маңызды құралы болды.[6]

Ынталандыру
[өңдеу | қайнарын өңдеу]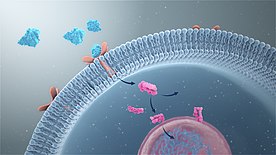
Белгілі бір тітіркендіргіштің биохимиялық сигналға айналуы сигнал берудің негізі болып табылады. Мұндай тітіркендіргіштердің табиғаты EGF бар болуы сияқты жасушадан тыс белгілерден бастап, репликативті теломера тозуы нәтижесінде ДНҚ зақымдануы сияқты жасушаішілік оқиғаларға дейін әртүрлі болуы мүмкін.[7] Дәстүрлі түрде орталық жүйке жүйесіне түсетін сигналдар сезім ретінде жіктеледі. Бұл нейроннан нейронға синаптикалық трансмиссия деп аталатын процесте беріледі. Көп жасушалы организмдерде басқа да көптеген жасушааралық сигнал релелік механизмдері бар, мысалы, эмбриональды дамуды басқаратындар.[8]
Лигандалар
[өңдеу | қайнарын өңдеу]Сигнал беру жолдарының көпшілігі лигандтар деп аталатын сигналдық молекулалардың жасуша ішіндегі оқиғаларды тудыратын рецепторлармен байланысуын қамтиды. Сигнал беру молекуласының рецептормен байланысуы рецепторлардың белсенділенуі деп аталатын рецептор конформациясының өзгеруіне әкеледі. Лигандтардың көпшілігі жасушадан тыс ортадағы еритін молекулалар, олар жасуша бетіндегі рецепторлармен байланысады. Оларға өсу факторлары, цитокиндер және нейротрансмиттерлер жатады. Жасушадан тыс матрицаның фибронектин және гиалуронан сияқты компоненттері де осындай рецепторлармен байланыса алады (тиісінше интегриндер және CD44). Сонымен қатар, стероидты гормондар сияқты кейбір молекулалар липидтерде ериді және осылайша цитоплазмалық немесе ядролық рецепторларға жету үшін плазмалық мембрана арқылы өтеді.[9] Стероидты гормондық рецепторлар жағдайында олардың стимуляциясы стероидтерге жауап беретін гендердің промоторлық аймағымен байланысуына әкеледі.[10]
Сигнал беру молекулаларының барлық классификациялары әрбір класс мүшесінің молекулалық табиғатын есепке алмайды. Мысалы, хош иістендіргіштер[11] молекулалық класстардың кең ауқымына жатады, олардың мөлшері дофамин сияқты кіші молекулалардан[12] эндорфиндер сияқты нейропептидтерге дейін өзгеретін нейротрансмиттерлер сияқты.[13] Сонымен қатар, кейбір молекулалар бірнеше класқа сәйкес келуі мүмкін, мысалы, эпинефрин орталық жүйке жүйесі бөлген кезде нейротрансмиттер болып табылады және бүйрек үсті безінің медулласынан бөлінетін гормон болып табылады.
HER2 сияқты кейбір рецепторлар шамадан тыс экспрессияланған немесе мутацияланған кезде лигандтарға тәуелсіз белсендіруге қабілетті. Бұл жолдың конститутивтік белсендірілуіне әкеледі, ол компенсация механизмдері арқылы жойылуы немесе жойылуы мүмкін. Басқа EGFR-лердің димеризация серіктесі ретінде әрекет ететін HER2 жағдайында конституитивтік белсендіру гиперпролиферацияға және қатерлі ісікке әкеледі.[14]
Механикалық күштер
[өңдеу | қайнарын өңдеу]Эуметазоандардың тіндерінде базальді мембраналардың таралуы көптеген жасуша түрлерінің өмір сүруі үшін бекітуді қажет ететінін білдіреді. Бұл талап жасушаларға субстраттың қаттылығын сезінуге мүмкіндік беретін күрделі механикалық өткізгіш жолдардың дамуына әкелді. Мұндай сигнализация негізінен интегринмен байланысқан актин цитоскелеті өзгерістерді анықтайтын және оларды YAP1 арқылы төмен қарай жіберетін фокальды адгезияларда, аймақтарда ұйымдастырылады.[15] Кадринден және селектиндер сияқты кальцийге тәуелді жасуша адгезиясы молекулалары да механотрандукцияға делдал бола алады.[16] Жүйке жүйесіндегі механикалық трансдукцияның мамандандырылған нысандары механикалық сезімге жауап береді: есту, сенсорлық, проприоцепция және тепе-теңдік.[17]
Осмолярлық
[өңдеу | қайнарын өңдеу]Осмостық қысымды жасушалық және жүйелік бақылау (цитозоль мен жасушадан тыс орта арасындағы осмолярлық айырмашылық) гомеостаз үшін өте маңызды. Жасушалардың осмостық тітіркендіргіштерді анықтауының үш әдісі бар: макромолекулярлық толып кетудің өзгеруі, иондық күштің өзгеруі және плазмалық мембрананың немесе цитоскелеттің қасиеттерінің өзгеруі (соңғысы механикалық трансдукцияның бір түрі).[18] Бұл өзгерістер осмоссенсорлар немесе осморецепторлар деп аталатын ақуыздар арқылы анықталады. Адамдарда ең жақсы сипатталған осмоссенсорлар адам жасушаларының бастапқы кірпікшелерінде болатын өтпелі рецепторлық потенциалдық арналар болып табылады.[18][19] Ашытқыда HOG жолы кеңінен сипатталған.[20]
Температура
[өңдеу | қайнарын өңдеу]Жасушалардағы температураны сезіну термоцепция ретінде белгілі және ең алдымен өтпелі рецепторлардың потенциалдық арналары арқылы жүзеге асырылады.[21] Сонымен қатар, жануарлардың жасушаларында жоғары температураның жасушалық зақымдануды, жылу соққысына реакциясын болдырмау үшін сақталған механизм бар. Мұндай реакция жоғары температура белсенді емес HSF1-нің Hsp40/Hsp70 және Hsp90 жылу соққылары бар кешендерінен диссоциациялануын тудырған кезде іске қосылады. ncRNA hsr1 көмегімен HSF1 тримеризацияланады, белсенді болады және мақсатты гендерінің экспрессиясын реттейді.[22] Көптеген басқа термосенсорлық механизмдер прокариоттарда да, эукариоттарда да бар.[21]
Жарық
[өңдеу | қайнарын өңдеу]Сүтқоректілерде жарық көздің тор қабығындағы фоторецепторлық жасушалардағы жарыққа сезімтал ақуыздарды белсендіру арқылы көру сезімін және тәуліктік сағатты басқарады. Көру жағдайында жарық таяқша мен конус жасушаларында родопсин арқылы анықталады.[23] Циркадиялық сағат жағдайында басқа фотопигмент, меланопсин, тордың фотосезімтал ганглион жасушаларында жарықты анықтауға жауап береді.[24]
Рецепторлар
[өңдеу | қайнарын өңдеу]Рецепторларды екі үлкен класқа бөлуге болады: жасушаішілік және жасушадан тыс рецепторлар.
Жасушадан тыс рецепторлар
[өңдеу | қайнарын өңдеу]Жасушадан тыс рецепторлар интегралды трансмембраналық ақуыздар болып табылады және рецепторлардың көпшілігін құрайды. Олар рецептордың бір бөлігі жасушаның сыртында, ал екіншісі ішкі жағында орналасқан жасушаның плазмалық мембранасын жайып жатыр. Сигналдың берілуі рецептордың сыртқы аймағымен лигандтың байланысуы нәтижесінде пайда болады (лиганд мембрана арқылы өтпейді). Лиганд-рецепторлардың байланысуы рецептордың ішкі бөлігінің конформациясының өзгеруін тудырады, бұл процесс кейде «рецепторларды белсендіру» деп аталады.[25] Бұл рецептордың ферменттік доменінің белсендірілуіне немесе жасуша ішіндегі басқа жасушаішілік сигналдық белоктарға байланыстыру орнының экспозициясына әкеледі, сайып келгенде, сигналды цитоплазма арқылы таратады.
Эукариоттық жасушаларда лиганд-рецепторлардың әрекеттесуімен белсендірілген жасушаішілік ақуыздардың көпшілігі ферментативті белсенділікке ие; мысалдарға тирозинкиназа және фосфатаза жатады. Көбінесе мұндай ферменттер рецептормен ковалентті байланысқан. Олардың кейбіреулері циклдік AMP және IP<sub id="mw1g">3</sub> сияқты екінші хабаршыларды жасайды, соңғылары жасушаішілік кальций қоймаларының цитоплазмаға шығарылуын бақылайды. Басқа белсендірілген белоктар белгілі бір тітіркендіргішке жауап беру үшін қажетті сигналдық кешендердің координациясын және сигналдық ақуыздың өзара әрекеттесуін жеңілдететін адаптер ақуыздарымен әрекеттеседі. Ферменттер мен адаптер белоктары әртүрлі екінші хабаршы молекулаларына жауап береді.
Сигнал беру бөлігі ретінде белсендірілген көптеген адаптер белоктары мен ферменттер арнайы екіншілік хабаршы молекулаларымен байланысатын арнайы протеиндік домендерге ие. Мысалы, кальций иондары кальмодулиннің EF қол домендерімен байланысып, оған кальмодулинге тәуелді киназаны байланыстыруға және белсендіруге мүмкіндік береді. PIP3 және басқа фосфоинозитидтер AKT киназа протеині сияқты белоктардың Плекстрин гомологиялық домендерімен бірдей әрекет жасайды.
G ақуыз-байланысқан рецепторлар
[өңдеу | қайнарын өңдеу]G протеинімен байланысқан рецепторлар (GPCR) - жеті трансмембраналық доменге ие және гетеротримерлі G протеинімен байланысқан интегралды трансмембраналық ақуыздар тобы. 800-ге жуық мүшесі бар бұл сүтқоректілердегі мембраналық ақуыздар мен рецепторлардың ең үлкен отбасы. Жануарлардың барлық түрлерін есептесек, олардың саны 5000-нан асады.[26] Сүтқоректілердің GPCR-тері 5 негізгі отбасына жіктеледі: родопсин тәрізді, секретин тәрізді, метаботропты глутамат, адгезия және бұралған/тегістелген, бірнеше GPCR топтары төмен реттілік ұқсастығына байланысты жіктеу қиын, мысалы, вомероназальды рецепторлар.[26] Басқа класстар эукариоттарда бар, мысалы, Dictyostelium циклдік AMP рецепторлары және саңырауқұлақ жұптасатын феромон рецепторлары.[26]
GPCR арқылы сигналды жіберу рецепторға қосылған белсенді емес G ақуызынан басталады; G ақуызы Gα, Gβ және Gγ суббірліктерінен тұратын гетеротример түрінде болады.[27] GPCR лигандты танығаннан кейін рецептордың конформациясы G протеинін белсендіру үшін өзгереді, бұл Gα GTP молекуласын байланыстырады және басқа екі G-белок суббірліктерінен диссоциацияланады. Диссоциация басқа молекулалармен әрекеттесе алатын суббірліктердегі учаскелерді ашады.[28] Белсендірілген G протеинінің суббірліктер рецептордан бөлініп, фосфолипазалар мен иондық арналар сияқты көптеген төменгі эффекторлық ақуыздардан сигнал беруді бастайды, соңғысы екінші хабаршы молекулаларының босатылуына мүмкіндік береді.[29] GPCR арқылы сигналды күшейтудің жалпы күші лиганд-рецепторлық кешеннің және рецептор-эффекторлық ақуыз кешенінің өмір сүру ұзақтығымен және активтендірілген рецептор мен эффекторлардың ішкі ферментативті белсенділік арқылы деактивация уақытымен анықталады; мысалы, протеинкиназаны фосфорлану немесе b-аррестинге тәуелді интернационализация арқылы.
CXCR2 химокиндік рецепторын кодтайтын генге нүктелік мутация енгізілген зерттеу жүргізілді; мутацияланған жасушалар химокинмен байланыстырудың жоқтығына қарамастан белсенді конформацияда CXCR2 экспрессиясына байланысты қатерлі трансформациядан өтті. Бұл химокиндік рецепторлардың қатерлі ісіктің дамуына ықпал етуі мүмкін дегенді білдіреді.[30]
Тирозин, Ser/Thr және гистидинге тән протеинкиназалар
[өңдеу | қайнарын өңдеу]Рецепторлық тирозинкиназалар (RTKs) - жасушаішілік киназа домені және лигандтарды байланыстыратын жасушадан тыс домені бар трансмембраналық ақуыздар; мысалдар инсулин рецепторы сияқты өсу факторы рецепторларын қамтиды.[31] Сигнал беруді орындау үшін RTK плазмалық мембранада димерлерді қалыптастыруы керек;[32] димер рецептормен байланысқан лигандтармен тұрақталады. Цитоплазмалық домендер арасындағы өзара әрекеттесу конформациялық өзгерістерді тудыратын RTK жасушаларының жасушаішілік киназдық домендеріндегі тирозин қалдықтарының автофосфорлануын ынталандырады. Осыдан кейін рецепторлардың киназдық домендері белсендіріліп, жасушаның дифференциациясы және метаболизмі сияқты әртүрлі жасушалық процестерді жеңілдететін төменгі цитоплазмалық молекулалардың фосфорлану сигналдық каскадтарын бастайды.[31] Көптеген Ser/Thr және қос спецификалық протеин киназалары рецепторлық тирозинкиназалардың төменгі ағынында немесе өз бетінше мембранаға енгізілген немесе жасушада еритін нұсқалар ретінде әрекет ететін сигнал беру үшін маңызды. Сигналдың берілу процесі адамның киномасы арқылы кодталған 560-қа жуық белгілі протеинкиназалар мен псевдокиназаларды қамтиды[33][34]
GPCR сияқты, GTP байланыстыратын ақуыздар белсендірілген RTK-дан жасушаға сигнал беруде маңызды рөл атқарады. Бұл жағдайда G протеиндері Ras, Rho және Raf отбасыларының мүшелері болып табылады, олар ұжымдық түрде шағын G ақуыздары деп аталады. Олар әдетте карбоксил ұштарымен байланысқан изопренил топтары арқылы мембраналарға байланған молекулалық қосқыштар ретінде әрекет етеді. Белсендірілгеннен кейін олар сигнал беруге қатысатын арнайы мембраналық субдомендерге ақуыздарды тағайындайды. Белсендірілген RTK өз кезегінде SOS1 сияқты гуанин нуклеотидтерінің алмасу факторларын белсендіретін шағын G ақуыздарын белсендіреді. Белсендірілгеннен кейін бұл алмасу факторлары көбірек кішігірім G ақуыздарын белсендіре алады, осылайша рецептордың бастапқы сигналын күшейтеді. Белгілі бір RTK гендерінің мутациясы, GPCRs сияқты, конститутивтік белсендірілген күйде бар рецепторлардың экспрессиясына әкелуі мүмкін; мұндай мутацияланған гендер онкогендер ретінде әрекет ете алады.[35]
Гистидинге тән ақуыз киназалары басқа ақуыз киназаларынан құрылымдық жағынан ерекшеленеді және прокариоттарда, саңырауқұлақтарда және өсімдіктерде екі компонентті сигнал беру механизмінің бөлігі ретінде кездеседі: АТФ-дан фосфат тобы алдымен киназаның ішіндегі гистидин қалдығына қосылады, содан кейін басқа ақуызға немесе киназаның өзіне қабылдау доменіндегі аспартат қалдығына ауысады, осылайша аспартат қалдығын белсендіреді.[36]
Интегриндер
[өңдеу | қайнарын өңдеу]
Интегриндерді алуан түрлі жасушалар шығарады; олар жасушаның басқа жасушаларға және жасушадан тыс матрицаға қосылуында және фибронектин және коллаген сияқты жасушадан тыс матрица компоненттерінің сигналдарын беруде рөл атқарады. Интегриндердің жасушадан тыс доменімен лигандтардың байланысуы белоктың конформациясын өзгертеді, сигнал беруді бастау үшін оны жасуша мембранасына біріктіреді. Интегриндерде киназа белсенділігі жоқ; демек, интегринмен байланысқан сигналды беру әртүрлі жасушаішілік ақуыз киназалары мен адаптер молекулалары арқылы жүзеге асырылады, негізгі үйлестіруші интегринмен байланысқан киназа болып табылады.[37] Көрші суретте көрсетілгендей, кооперативтік интегрин-RTK сигнализациясы жасушаның өмір сүруінің, апоптоздың, пролиферацияның және дифференциацияның уақытын анықтайды.
Айналымдағы қан жасушаларында интегрин-сигналдар мен эпителий жасушалары сияқты айналымда емес жасушалар арасында маңызды айырмашылықтар бар; Айналымдағы жасушалардың интегриндері әдетте белсенді емес. Мысалы, айналымдағы лейкоциттердегі жасуша мембранасының интегриндері эпителий жасушаларының бекітілуін болдырмау үшін белсенді емес күйде сақталады; олар тек қабыну реакциясы орнында қабылданған ынталандыруларға жауап ретінде белсендіріледі. Сол сияқты, тромбоциттерді болдырмау үшін айналымдағы тромбоциттердің жасушалық мембранасындағы интегриндер әдетте белсенді емес сақталады. Эпителий жасушалары (айналмайтын) әдетте жасуша мембранасында белсенді интегриндерге ие болады, бұл олардың қалыпты жұмыс істеуін қамтамасыз ету үшін сигнал беретін негізгі стромальды жасушаларға тұрақты адгезиясын сақтауға көмектеседі.[38]
Өсімдіктерде бүгінгі күнге дейін анықталған адал интегрин рецепторлары жоқ; дегенмен, метазоандық рецепторлармен құрылымдық гомология негізінде бірнеше интегрин тәрізді ақуыздар ұсынылды.[39] Өсімдіктерде интегринмен байланысқан киназалар бар, олар бастапқы құрылымы бойынша жануарлардың ILK-ларына өте ұқсас. ILK1 интегринмен байланысқан киназа гендерінің бірі Arabidopsis thaliana эксперименттік үлгісінде өсімдіктің бактериялық қоздырғыштардың сигнал молекулаларына және өсімдіктің тұзға және осмостық стресске сезімталдығына иммундық реакциясының маңызды элементі екендігі көрсетілді.[40] ILK1 протеині HAK5 жоғары аффинді калий тасымалдаушысымен және CML9 кальций сенсорымен әрекеттеседі.[40][41]
Төлем тәрізді рецепторлар
[өңдеу | қайнарын өңдеу]Белсендірілген кезде, ақылы рецепторлар (TLR) сигналды тарату үшін жасушалардың цитоплазмасында адаптер молекулаларын алады. Сигнал беруге төрт адаптер молекуласы қатысатыны белгілі, олар Myd88, TIRAP, TRIF және TRAM.[42][43] [44] Бұл адаптерлер сигналды күшейтетін IRAK1, IRAK4, TBK1 және IKKi сияқты басқа жасушаішілік молекулаларды белсендіреді, сайып келгенде белгілі бір жауаптарды тудыратын гендердің индукциясына немесе басылуына әкеледі. Мыңдаған гендер TLR сигнализациясы арқылы белсендіріледі, бұл әдіс гендік модуляция үшін маңызды шлюз екенін білдіреді.
Лигандпен жабылған иондық арналар
[өңдеу | қайнарын өңдеу]Лигандпен байланыстырылған иондық арна, лигандпен байланысқаннан кейін, жасуша мембранасындағы иондар релелік сигналдар өтетін арнаны ашу үшін конформациясын өзгертеді. Бұл механизмнің мысалы нейрондық синапстың қабылдаушы жасушасында кездеседі. Осы арналардың ашылуына жауап ретінде пайда болатын иондардың ағыны постсинапстық жасушалардың мембранасын деполяризациялау арқылы жүйкелер бойымен жүретіндер сияқты әрекет потенциалдарын тудырады, нәтижесінде кернеуге байланысты иондық арналар ашылады.
Лигандамен жабылған иондық арнаның ашылуы кезінде жасушаға рұқсат етілген ионның мысалы Са2+; ол сигнал беру каскадтарын бастайтын және жауап беретін жасушаның физиологиясын өзгертетін екінші хабаршы ретінде әрекет етеді. Бұл синапсқа қатысатын дендритті омыртқаларды қайта құру арқылы синапстық жасушалар арасындағы синапс реакциясының күшеюіне әкеледі.
Жасуша ішілік рецепторлар
[өңдеу | қайнарын өңдеу]Ядролық рецепторлар және цитоплазмалық рецепторлар сияқты жасушаішілік рецепторлар өздерінің тиісті аймақтарында локализацияланған еритін ақуыздар болып табылады. Ядролық рецепторларға тән лигандтар стероидты гормондар тестостерон мен прогестерон сияқты полярлы емес гормондар және А және D витаминдерінің туындылары болып табылады. Сигнал беруді бастау үшін лиганд пассивті диффузия арқылы плазмалық мембрана арқылы өтуі керек. Рецептормен байланысқан кезде лигандтар ядролық мембрана арқылы ядроға өтіп, ген экспрессиясын өзгертеді.
Белсендірілген ядролық рецепторлар ДНҚ-ға гормон-рецепторлық кешенмен белсендірілген гендердің промоторлық аймағында орналасқан рецепторларға тән гормонға жауап беретін элемент (HRE) тізбегі бойынша бекітіледі. Геннің транскрипциясын қамтамасыз ететіндіктен, оларды ген экспрессиясының индукторлары деп атайды. Геннің экспрессиясын реттеу арқылы әрекет ететін барлық гормондардың әсер ету механизмінде екі салдары бар; олардың әсері тән ұзақ уақыт кезеңінен кейін пайда болады және олардың әсері лигандты деактивациялайтын немесе тоқтататын көптеген ферменттер мен ақуыздардың салыстырмалы түрде баяу айналымына байланысты олардың концентрациясы нөлге дейін төмендегеннен кейін де басқа ұзақ уақыт бойы сақталады. рецепторлармен байланысады.
Нуклеиндік рецепторлардың құрамында мырыш саусақтары және лигандтарды байланыстыратын домені бар ДНҚ-байланыстырушы домендері бар; мырыш саусақтары ДНҚ байланысын оның фосфатты омыртқасын ұстап тұру арқылы тұрақтандырады. Рецепторға сәйкес келетін ДНҚ тізбегі әдетте кез келген түрдегі гексамерлі қайталанулар болып табылады; тізбектері ұқсас, бірақ олардың бағыты мен қашықтығы оларды ажыратады. Лиганды байланыстырушы домен нуклеиндік рецепторлардың байланысқанға дейін димеризациялануына және трансактациялық аппаратпен байланыс үшін пайдаланылатын трансактивация құрылымдарын қамтамасыз етуге қосымша жауап береді.
Стероидты рецепторлар негізінен цитозоль ішінде орналасқан ядролық рецепторлардың қосалқы класы болып табылады. Стероидтер болмаған жағдайда олар шаперон немесе жылу шок ақуыздары (HSPs) бар апорецепторлық кешенде біріктіріледі. HSP-тер ақуыздың ядроға өтуіне мүмкіндік беретін сигнал тізбегі қолжетімді болатындай етіп қатпарлануына көмектесу арқылы рецепторды белсендіру үшін қажет. Стероидты рецепторлар, керісінше, олардың трансактивті домені жасырылған кезде ген экспрессиясына репрессивті болуы мүмкін. Рецепторлардың белсенділігін олардың N-терминалындағы серин қалдықтарының фосфорлануы арқылы сигнал берудің басқа жолы, яғни айқас сөйлесу деп аталатын процесс нәтижесінде күшейтуге болады.
Ретиной қышқылы рецепторлары ядролық рецепторлардың тағы бір бөлігі болып табылады. Оларды жасушаға диффузия арқылы енген эндокриндік синтезделген лиганд, қан арқылы жасушаға әкелінетін ретинол сияқты прекурсордан синтезделген лиганд немесе простагландин сияқты толығымен жасушаішілік синтезделген лиганд арқылы белсендіруге болады. Бұл рецепторлар ядрода орналасқан және HSP-мен бірге жүрмейді. Ешбір лиганд байланыспаған кезде, олар ДНҚ-ның нақты тізбегімен байланысу арқылы өз генін репрессиялайды және керісінше.
Иммундық жүйенің кейбір жасушаішілік рецепторлары цитоплазмалық рецепторлар болып табылады. Жақында анықталған NOD тәрізді рецепторлар (NLR) кейбір эукариоттық жасушалардың цитоплазмасында орналасады және TLR-ге ұқсас лейцинге бай қайталану (LRR) мотивін пайдаланып лигандтармен әрекеттеседі. NOD2 сияқты осы молекулалардың кейбіреулері NF-κB сигнализациясын белсендіретін RIP2 киназасымен әрекеттеседі, ал басқалары NALP3 қабыну каспазаларымен әрекеттеседі және интерлейкин-1 β сияқты белгілі бір цитокиндерді өңдеуді бастайды.[45][46]
Екінші хабаршылар
[өңдеу | қайнарын өңдеу]Бірінші хабаршылар - жасушадан тыс сұйықтықтан жасушаға жететін және олардың арнайы рецепторларымен байланысатын сигналдық молекулалар (гормондар, нейротрансмиттерлер және паракриндік/автокриндік агенттер). Екінші хабаршылар - цитоплазмаға енетін және жауап беру үшін жасуша ішінде әрекет ететін заттар. Негізінде екінші хабаршылар плазмалық мембранадан цитоплазмаға химиялық реле ретінде қызмет етеді, осылайша жасушаішілік сигнал беруді жүзеге асырады.
Кальций
[өңдеу | қайнарын өңдеу]Кальций иондарының эндоплазмалық ретикулумнан цитозолға шығарылуы оның кейін белсендірілетін сигналдық белоктармен байланысуына әкеледі; содан кейін ол тегіс эндоплазмалық ретикулумда[47] және митохондрияда секвестрленеді. Екі біріктірілген рецепторлық/иондық арна ақуыздары кальцийдің тасымалдануын бақылайды: цитозолдық жағында инозитолтрифосфатпен әрекеттескен кезде кальцийді тасымалдайтын InsP<sub id="mwAbI">3</sub>-рецептор; және InsP3 рецепторына ұқсас, бірақ онымен байланысу кезінде кальцийді көбірек бөлетін кері байланыс механизмі бар рианодин алкалоидының атымен аталған рианодиндік рецептор. Цитозольдегі кальцийдің табиғаты оның өте қысқа уақытқа ғана белсенді екендігін білдіреді, яғни оның бос күйінің концентрациясы өте төмен және белсенді емес кезде негізінен калретикулин сияқты органеллалар молекулаларымен байланысады.
Кальций бұлшықеттердің жиырылуын, жүйке ұштарынан нейротрансмиттерлерді шығаруды және жасуша миграциясын қоса алғанда көптеген процестерде қолданылады. Оның белсендірілуіне әкелетін үш негізгі жол GPCR жолдары, RTK жолдары және қақпалы иондық арналар; ол ақуыздарды тікелей немесе ферментпен байланысу арқылы реттейді.
Липидтердің хабаршылары
[өңдеу | қайнарын өңдеу]Липофильді екінші хабаршы молекулалар жасуша мембраналарында тұратын липидтерден алынған; белсендірілген рецепторлармен ынталандырылған ферменттер липидтерді өзгерту арқылы белсендіреді. Мысалы, диацилглицерол және керамид жатады, біріншісі протеинкиназа С белсендіру үшін қажет.
Азот оксиді
[өңдеу | қайнарын өңдеу]Азот оксиді (NO) екінші хабаршы ретінде әрекет етеді, өйткені ол плазмалық мембрана арқылы диффузиялануы және жақын орналасқан жасушаларға әсер етуі мүмкін бос радикал. Ол NO синтаза арқылы аргинин мен оттегіден синтезделеді және белсендірілген кезде басқа екінші хабаршы cGMP түзетін еритін гуаниллил циклазаны белсендіру арқылы жұмыс істейді. NO ақуыздардың немесе олардың металл ко-факторларының ковалентті модификациясы арқылы да әсер ете алады; кейбірінің тотығу-тотықсыздану механизмі бар және қайтымды. Ол жоғары концентрацияларда улы және инсульт кезінде зақым келтіреді, бірақ қан тамырларының босаңсуы, апоптоз және пениса эрекциясы сияқты көптеген басқа функциялардың себебі болып табылады.
Тотығу-тотықсыздану сигналы
[өңдеу | қайнарын өңдеу]Азот оксидінен басқа, электронды түрде белсендірілген басқа түрлер де тотығу-тотықсыздану сигнализациясы деп аталатын процесте сигналды түрлендіретін агенттер болып табылады. Мысалдар супероксид, сутегі асқын тотығы, көміртек тотығы және күкіртті сутек. Тотығу-тотықсыздану сигналы сонымен қатар жартылай өткізгіш биологиялық макромолекулалардағы электрондық ағындардың белсенді модуляциясын қамтиды.[48]
Жасушалық жауаптар
[өңдеу | қайнарын өңдеу]Гендердің белсендіруі[49] және метаболизмнің өзгеруі[50] сигнал беруді қажет ететін жасушадан тыс ынталандыруға жасушалық жауаптардың мысалдары болып табылады. Геннің активтенуі одан әрі жасушалық әсерлерге әкеледі, өйткені жауап беретін гендердің өнімдері белсендірудің қоздырғыштарын қамтиды; сигнал беру каскады нәтижесінде түзілетін транскрипция факторлары одан да көп гендерді белсендіре алады. Демек, бастапқы ынталандыру көптеген гендердің экспрессиясын тудыруы мүмкін, бұл қан ағымынан глюкозаның жоғарылауы[50] және нейтрофилдердің инфекция орындарына көшуі сияқты физиологиялық оқиғаларға әкеледі. Гендердің жиынтығы және олардың белгілі бір тітіркендіргіштерге активтену тәртібі генетикалық бағдарлама деп аталады .[51]
Сүтқоректілердің жасушалары жасушаның бөлінуі мен өмір сүруі үшін ынталандыруды қажет етеді; өсу факторы болмаған жағдайда апоптоз пайда болады. Жасушадан тыс стимуляцияға қойылатын мұндай талаптар біржасушалы және көпжасушалы организмдердегі жасушалық әрекетті бақылау үшін қажет; Сигналдарды тарату жолдары биологиялық процестерде орталық орын алатыны соншалық, көптеген аурулар олардың реттелуіне байланысты. Үш негізгі сигнал жасушаның өсуін анықтайды:
- Ынталандырушы (өсу факторлары)
- Транскрипцияға тәуелді жауап
Мысалы, стероидтар тікелей транскрипция факторы ретінде әрекет етеді (баяу жауап береді, өйткені транскрипция факторы ДНҚ-ны байланыстыруы керек, оны транскрипциялау қажет. Өндірілген мРНҚ трансляциялануы керек, ал өндірілген ақуыз/пептид посттрансляциялық модификациядан (PTM) өтуі мүмкін) - Транскрипцияға тәуелсіз жауап
Мысалы, эпидермиялық өсу факторы (EGF) эпидермиялық өсу факторы рецепторын (EGFR) байланыстырады, бұл EGFR димеризациясын және автофосфорлануын тудырады, бұл өз кезегінде жасушаішілік сигнал беру жолын белсендіреді.[52]
- Транскрипцияға тәуелді жауап
- Тежегіш (жасуша-жасуша байланысы)
- Рұқсат етуші (жасуша-матрица әрекеттесуі)
Бұл сигналдардың комбинациясы өзгертілген цитоплазмалық аппаратқа біріктіріліп, жасуша мінез-құлқының өзгеруіне әкеледі.
Негізгі жолдар
[өңдеу | қайнарын өңдеу]

Төменде олардың рецепторларымен байланысатын лигандтардың екінші хабаршыларға қалай әсер ететінін және сайып келгенде жасушалық жауаптардың өзгеруіне әкелетінін көрсететін кейбір негізгі сигнал жолдары берілген.
- MAPK/ERK жолы: өсу факторларының жасуша бетіндегі рецепторлармен байланысуына жасушаішілік жауаптарды біріктіретін жол. Бұл жол өте күрделі және көптеген ақуыз компоненттерін қамтиды.[53] Көптеген жасуша түрлерінде бұл жолдың белсендірілуі жасушаның бөлінуіне ықпал етеді және қатерлі ісіктің көптеген түрлері ондағы аберрациялармен байланысты.[54]
- cAMP-тәуелді жол: Адамдарда cAMP протеинкиназа А (PKA, cAMP-тәуелді протеинкиназа) белсендіру арқылы жұмыс істейді (суретті қараңыз) және осылайша одан әрі әсерлер негізінен түріне байланысты өзгеретін cAMP-тәуелді протеинкиназаға байланысты жасушаның.
- IP3 DAG жолы: PLC фосфолипидті фосфатидилинозитол 4,5-бисфосфатты (PIP2) ыдыратып, диацилглицерин (DAG) және инозитол 1,4,5-трифосфат (IP3) береді. DAG мембранамен байланысқан күйінде қалады, ал IP3 еритін құрылым ретінде цитозолға шығарылады. Содан кейін IP3 цитозоль арқылы IPmwAh8 рецепторларымен, әсіресе эндоплазмалық ретикулумдағы (ER) кальций арналарымен байланысу үшін диффузияланады. Бұл арналар кальцийге тән және тек кальцийдің өтуіне мүмкіндік береді. Бұл кальцийдің цитозолдық концентрациясының жоғарылауын тудырады, бұл жасушаішілік өзгерістер мен белсенділіктің каскадын тудырады.[55] Сонымен қатар, кальций мен DAG бірге PKC белсендіру үшін жұмыс істейді, ол басқа молекулаларды фосфорлайды, бұл жасушалық белсенділіктің өзгеруіне әкеледі. Ақырғы әсерлерге дәм, маниакальды депрессия, ісіктерді ынталандыру және т.б. жатады.
Тарих
[өңдеу | қайнарын өңдеу]
Сигнал беру туралы ең алғашқы ұғымды 1855 жылы Клод Бернард көкбауыр, қалқанша және бүйрек үсті бездері сияқты түтіксіз бездер физиологиялық әсерлері бар «ішкі секрецияларды» шығаруға жауапты деп ұсынған кезден бастауға болады.[56] Бернардтың «секреттерін» кейінірек 1905 жылы Эрнест Старлинг «гормондар» деп атады.[57] Уильям Бейлисспен бірге Старлинг 1902 жылы секретинді ашты.[56] Көптеген басқа гормондар, әсіресе инсулин, келесі жылдары табылғанымен, механизмдері негізінен белгісіз болып қалды.
1954 жылы Рита Леви-Монтальчини нерв өсу факторын және 1962 жылы Стэнли Коэннің эпидермиялық өсу факторын ашу жасуша сигнализациясының молекулалық негізін, атап айтқанда өсу факторларын егжей-тегжейлі түсінуге әкелді.[58] Олардың жұмысы Эрл Уилбур Сазерлендтің 1956 жылы циклдік AMP ашуымен бірге эндокриндік сигналды қайта анықтауды тек бездерден келетін сигналдарды қамтуға итермеледі, ал автокрин және паракрин терминдері қолданыла бастады.[59] Сазерленд 1971 жылы физиология немесе медицина бойынша Нобель сыйлығын алды, ал Леви-Монталчини мен Коэн 1986 жылы оны бөлісті.
1970 жылы Мартин Родбелл глюкагонның егеуқұйрықтың бауыр жасушаларының мембранасының рецепторларына әсерін зерттеді. Ол гуанозин трифосфаты глюкагонды осы рецептордан ажыратып, жасуша метаболизміне қатты әсер ететін G-белокты ынталандыратынын атап өтті. Осылайша, ол G-белок глюкагон молекулаларын қабылдайтын және жасушаға әсер ететін түрлендіргіш екенін қорытындылады.[60] Бұл үшін ол физиология немесе медицина саласындағы 1994 жылғы Нобель сыйлығын Альфред Дж. Гилманмен бөлісті. Осылайша, RTKs және GPCRs сипаттамасы 1972 жылы алғаш рет қолданылған сөз «сигнал беру» ұғымының тұжырымдалуына әкелді.[61] Кейбір ерте мақалаларда сигнал беру және сенсорлық трансдукция терминдері қолданылды.[62][63] 2007 жылы осы тақырып бойынша барлығы 48 377 ғылыми мақала, оның ішінде 11 211 шолу мақаласы жарияланды. Термин алғаш рет 1979 жылы мақаланың атауында пайда болды.[64][65] Терминнің кеңінен қолданылуы 1980 жылы Родбеллдің шолу мақаласынан байқалады:[60] Сигналдарды таратуға бағытталған зерттеу жұмыстары алғаш рет 1980-жылдардың соңы мен 1990-жылдардың басында көптеп пайда болды.[46]
Иммунологиядағы сигналдың берілуі
[өңдеу | қайнарын өңдеу]Бұл бөлімнің мақсаты 1960 және 1970 жылдардағы иммунологиядағы кейбір өзгерістерді қысқаша сипаттау, трансмембраналық сигнал берудің бастапқы кезеңдеріне қатысты және олардың иммунологияны түсінуімізге, сайып келгенде жасуша биологиясының басқа салаларына қалай әсер еткенін сипаттау.
Тиісті оқиғалар миелома белоктарының жеңіл тізбектерінің секвенирленуінен басталады, олар көп миеломасы бар адамдардың зәрінде көп кездеседі. Биохимиялық эксперименттер Бенс Джонс деп аталатын белоктардың 2 дискретті доменнен тұратынын анықтады – біреуі бір молекуладан екіншісіне (V домені) өзгеретін және екіншісі жоқ (Fc домені немесе Фрагменттің кристалданатын аймағы).[66] Ву және Кабат[67] жасаған бірнеше V аймақтық тізбектердің талдауы V аймағындағы гиперөзгермелі орындарды анықтады және олар гипотеза бойынша антигенді тану орнын құру үшін қатпарланған ақуызға біріктірілген. Осылайша, салыстырмалы түрде қысқа уақыт ішінде иммунологиялық ерекшеліктің молекулярлық негізі үшін және Fc домені арқылы биологиялық функцияның делдалдылығы үшін қолайлы модель жасалды. Көп ұзамай IgG молекуласының кристалдануы[68] ) секвенирлеуге негізделген қорытындыларды растады және рұқсаттың ең жоғары деңгейінде иммунологиялық ерекшелік туралы түсінікті қамтамасыз етті.
Бұл құбылыстардың биологиялық маңызы клондық сұрыпталу теориясында [69] қамтылған, ол В-жасушасының бетінде антигенмен байланысатын жері жасушадан бөлінетін антиденелермен бірдей болатын иммуноглобулин рецепторлары болады деп есептейді. антиген, дәлірек айтқанда, белгілі бір В жасуша клоны бірдей реттілікпен антиденелерді бөледі. Әңгіменің соңғы бөлігі, плазмалық мембрананың сұйық мозаикалық үлгісі сигнал беруді бастау үшін жаңа модель үшін барлық ингредиенттерді қамтамасыз етті; яғни рецепторлардың димерленуі.
Бұл туралы алғашқы анықтамаларды Беккер және басқалары[70] алды, олар адам базофилдерінің — бивалентті иммуноглобулин Е (IgE) беткі рецептор ретінде қызмет ететін — дегрануляция дәрежесі IgE антиденелерінің концентрациясына байланысты екенін көрсетті. олар әсер етеді және беттік молекулалардың қайта бөлінуіне әкеледі, бұл моновалентті лигандты қолданғанда болмайды. Соңғы бақылау Фангер және т.б.[71] Бұл бақылаулар оқиғаларға және жасуша бетіндегі молекулалардың құрылымдық бөлшектеріне биологиялық жауапты байланыстырды. Көп ұзамай рецепторлардың димеризациясы әртүрлі жасуша түрлерінде, соның ішінде В жасушаларында жауаптарды бастайтыны туралы дәлелдердің (басымдығы пайда болды[72]).
Мұндай бақылаулар бірқатар теориялық (математикалық) жаңалықтарға әкелді. Олардың біріншісі Белл[73] ұсынған қарапайым модель болды, ол айқын парадоксты шешті: кластерлеу тұрақты желілерді құрайды; яғни байланысуы негізінен қайтымсыз, ал В жасушалары бөлетін антиденелердің жақындығы иммундық жауаптың өсуіне қарай артады. Лимфоциттердің мембраналарындағы жасуша бетінің кластерленуінің динамикасының теориясын ДеЛиси мен Перельсон[74] дамытты, олар кластерлердің өлшемдік таралуын уақытқа байланысты және оның лигандтың жақындығы мен валенттілігіне тәуелділігін анықтады. Базофилдер мен мастикалық жасушалардың кейінгі теорияларын Голдштейн мен Соботка және олардың әріптестері[75][76] әзірледі, олардың барлығы иммундық жасушалардың доза-жауап үлгілерін және олардың биологиялық корреляциясын талдауға бағытталған.[77] Иммунологиялық жүйелердегі кластерлеуге жақында шолу үшін қараңыз.
Лигандтардың жасуша бетіндегі рецепторлармен байланысуы моторика үшін де маңызды, бұл құбылыс бір жасушалы организмдерде жақсы түсініледі. Мысал ретінде бактериялардың концентрация градиенттерін анықтау және оларға жауап беру[78] – классикалық математикалық теория[79] пайда болады. Соңғы есептік жазбаны[80] ішінен табуға болады
Сондай-ақ қараңыз
[өңдеу | қайнарын өңдеу]- Адаптер ақуызы
- Скаффор протеині
- Биосемиотика
- Жасуша сигнализациясы
- Гендік реттеуші желі
- Гормоналды таңбалау
- Метаболизм жолы
- Ақуыз бен ақуыздың әрекеттесуі
- Екі компонентті реттеу жүйесі
Дереккөздер
[өңдеу | қайнарын өңдеу]- ↑ Handbook of Cell Signaling — 2nd. — Amsterdam, Netherlands: Academic Press. — ISBN 9780123741455.
- ↑ Reconstruction of cellular signalling networks and analysis of their properties. February 2005.
- ↑ {{{тақырыбы}}}. — ISBN 978-3527313976.
- ↑ {{{тақырыбы}}}. — ISBN 978-0-8053-6624-2.
- ↑ The dynamic control of signal transduction networks in cancer cells.
- ↑ Bago R, Sommer E, Castel P, Crafter C, Bailey FP, Shpiro N, Baselga J, Cross D, Eyers PA, Alessi DR (2016) The hVps34-SGK3 pathway alleviates sustained PI3K/Akt inhibition by stimulating mTORC1 and tumour growth. EMBO Journal 35:1902-22
- ↑ "Different telomere damage signaling pathways in human and mouse cells". The EMBO Journal 21 (16): 4338–48. August 2002. doi:10.1093/emboj/cdf433. PMC 126171. PMID 12169636.
- ↑ "Mosaic and regulative development: two faces of one coin". Current Biology 16 (7): R236-9. April 2006. doi:10.1016/j.cub.2006.03.016. PMID 16581495.
- ↑ "Transcriptional regulation by steroid hormones". Steroids 61 (4): 240–51. April 1996. doi:10.1016/0039-128X(96)00030-X. PMID 8733009.
- ↑ "The further redefining of steroid-mediated signaling". Proceedings of the National Academy of Sciences of the United States of America 100 (5): 2168–70. March 2003. doi:10.1073/pnas.0530224100. PMID 12606724.
- ↑ "G proteins and olfactory signal transduction". Annual Review of Physiology 64 (1): 189–222. 2002. doi:10.1146/annurev.physiol.64.082701.102219. PMID 11826268.
- ↑ "Dopamine receptors: from structure to function". Physiological Reviews 78 (1): 189–225. doi:10.1152/physrev.1998.78.1.189. PMID 9457173.
- ↑ "Opioid peptides endorphins in pituitary and brain". Science 193 (4258): 1081–6. doi:10.1126/science.959823. PMID 959823.
- ↑ "Comprehensive molecular portraits of human breast tumours". Nature 490 (7418): 61–70. October 2012. doi:10.1038/nature11412. PMC 3465532. PMID 23000897.
- ↑ "Role of YAP/TAZ in mechanotransduction". Nature 474 (7350): 179–83. doi:10.1038/nature10137. PMID 21654799.
- ↑ "Cellular mechanotransduction: putting all the pieces together again". FASEB Journal 20 (7): 811–27. doi:10.1096/fj.05-5424rev. PMID 16675838.
- ↑ "A possible unifying principle for mechanosensation". Nature 436 (7051): 647–54. doi:10.1038/nature03896. PMID 16079835.
- ↑ a b "Osmosensory mechanisms in cellular and systemic volume regulation". Journal of the American Society of Nephrology 22 (9): 1587–97. September 2011. doi:10.1681/ASN.2010121284. PMID 21852585.
- ↑ "How does the brain sense osmolality?". Journal of the American Society of Nephrology 18 (12): 3056–9. December 2007. doi:10.1681/ASN.2007070825. PMID 18003769.
- ↑ "Osmotic stress signaling and osmoadaptation in yeasts". Microbiology and Molecular Biology Reviews 66 (2): 300–72. June 2002. doi:10.1128/MMBR.66.2.300-372.2002. PMID 12040128.
- ↑ a b "Sensing temperature". Current Biology 23 (8): R304-7. April 2013. doi:10.1016/j.cub.2013.03.009. PMC 3685181. PMID 23618661.
- ↑ "RNA-mediated response to heat shock in mammalian cells". Nature 440 (7083): 556–60. March 2006. doi:10.1038/nature04518. PMID 16554823.
- ↑ "Beyond counting photons: trials and trends in vertebrate visual transduction". Neuron 48 (3): 387–401. November 2005. doi:10.1016/j.neuron.2005.10.014. PMID 16269358.
- ↑ "Phototransduction in ganglion-cell photoreceptors". Pflügers Archiv 454 (5): 849–55. August 2007. doi:10.1007/s00424-007-0242-2. PMID 17351786.
- ↑ A molecular model for receptor activation.
- ↑ a b c "The repertoire of G-protein-coupled receptors in fully sequenced genomes". Molecular Pharmacology 67 (5): 1414–25. May 2005. doi:10.1124/mol.104.009001. PMID 15687224.
- ↑ Inactive-state preassembly of G(q)-coupled receptors and G(q) heterotrimers.
- ↑ {{{тақырыбы}}}. — ISBN 978-0-7167-4954-7.
- ↑ Mechanisms of regulation and function of G-protein-coupled receptor kinases. 2006.
- ↑ "Point mutation causing constitutive signaling of CXCR2 leads to transforming activity similar to Kaposi's sarcoma herpesvirus-G protein-coupled receptor". Journal of Immunology 163 (4): 2017–22. August 1999. PMID 10438939.
- ↑ a b Role of receptor tyrosine kinase transmembrane domains in cell signaling and human pathologies.
- ↑ Signal transduction by allosteric receptor oligomerization.
- ↑ The protein kinase complement of the human genome.
- ↑ Day of the dead: pseudokinases and pseudophosphatases in physiology and disease.
- ↑ "The ErbB/HER receptor protein-tyrosine kinases and cancer". Biochemical and Biophysical Research Communications 319 (1): 1–11. June 2004. doi:10.1016/j.bbrc.2004.04.150. PMID 15158434.
- ↑ "Histidine protein kinases: key signal transducers outside the animal kingdom". Genome Biology 3 (10): REVIEWS3013. September 2002. doi:10.1186/gb-2002-3-10-reviews3013. PMC 244915. PMID 12372152.
- ↑ a b "Signalling via integrins: implications for cell survival and anticancer strategies". Biochimica et Biophysica Acta (BBA) - Reviews on Cancer 1775 (1): 163–80. January 2007. doi:10.1016/j.bbcan.2006.09.001. PMID 17084981. Дереккөз қатесі: Invalid
<ref>tag; name "hehlgans" defined multiple times with different content - ↑ "Integrin signaling in epithelial cells". Cancer Letters 247 (1): 1–25. March 2007. doi:10.1016/j.canlet.2006.03.031. PMID 16725254.
- ↑ "Arabidopsis NDR1 is an integrin-like protein with a role in fluid loss and plasma membrane-cell wall adhesion". Plant Physiology 156 (1): 286–300. May 2011. doi:10.1104/pp.110.169656. PMC 3091050. PMID 21398259.
- ↑ a b "The Raf-like Kinase ILK1 and the High Affinity K+ Transporter HAK5 Are Required for Innate Immunity and Abiotic Stress Response". Plant Physiology 171 (2): 1470–84. June 2016. doi:10.1104/pp.16.00035. PMC 4902592. PMID 27208244.
- ↑ "Differential binding of calmodulin-related proteins to their targets revealed through high-density Arabidopsis protein microarrays". Proceedings of the National Academy of Sciences of the United States of America 104 (11): 4730–5. March 2007. doi:10.1073/pnas.0611615104. PMC 1838668. PMID 17360592.
- ↑ "Role of adaptor TRIF in the MyD88-independent toll-like receptor signaling pathway". Science 301 (5633): 640–3. August 2003. Bibcode 2003Sci...301..640Y. doi:10.1126/science.1087262. PMID 12855817.
- ↑ "TRAM is specifically involved in the Toll-like receptor 4-mediated MyD88-independent signaling pathway". Nature Immunology 4 (11): 1144–50. November 2003. doi:10.1038/ni986. PMID 14556004.
- ↑ "Essential role for TIRAP in activation of the signalling cascade shared by TLR2 and TLR4". Nature 420 (6913): 324–9. November 2002. Bibcode 2002Natur.420..324Y. doi:10.1038/nature01182. PMID 12447441.
- ↑ "Innate recognition of intracellular bacteria". Current Opinion in Immunology 19 (1): 10–6. February 2007. doi:10.1016/j.coi.2006.11.005. PMID 17126540.
- ↑ a b {{{тақырыбы}}}. — P. 159–60. Дереккөз қатесі: Invalid
<ref>tag; name "Vander_1998" defined multiple times with different content - ↑ "Steatosis inhibits liver cell store-operated Ca²⁺ entry and reduces ER Ca²⁺ through a protein kinase C-dependent mechanism". The Biochemical Journal 466 (2): 379–90. March 2015. doi:10.1042/bj20140881. PMID 25422863.
- ↑ "Signal transduction and reactive species". Free Radical Biology & Medicine 47 (9): 1237–8. November 2009. doi:10.1016/j.freeradbiomed.2009.09.002. PMID 19735727.
- ↑ "Signal transduction and gene regulation: the nuclear response to cAMP". The Journal of Biological Chemistry 269 (26): 17359–62. July 1994. doi:10.1016/S0021-9258(17)32442-0. PMID 8021233.
- ↑ a b "After insulin binds". Science 237 (4821): 1452–8. September 1987. doi:10.1126/science.2442814. PMID 2442814.
- ↑ "The logic of TGFbeta signaling". FEBS Letters 580 (12): 2811–20. May 2006. doi:10.1016/j.febslet.2006.04.033. PMID 16678165.
- ↑ "Single-molecule imaging of EGFR signalling on the surface of living cells". Nature Cell Biology 2 (3): 168–72. March 2000. doi:10.1038/35004044. PMID 10707088.
- ↑ "Computational modelling of the receptor-tyrosine-kinase-activated MAPK pathway". The Biochemical Journal 392 (Pt 2): 249–61. December 2005. doi:10.1042/BJ20050908. PMC 1316260. PMID 16293107.
- ↑ "Cancer genes and the pathways they control". Nature Medicine 10 (8): 789–99. August 2004. doi:10.1038/nm1087. PMID 15286780.
- ↑ Дереккөз қатесі: Жарамсыз
<ref>тегі; no text was provided for refs namedalberts - ↑ a b Bradshaw & Dennis (2010) p. 1.
- ↑ "One hundred years of hormones". EMBO Reports 6 (6): 490–6. June 2005. doi:10.1038/sj.embor.7400444. PMC 1369102. PMID 15940278.
- ↑ "Viktor Hamburger and Rita Levi-Montalcini: the path to the discovery of nerve growth factor". Annual Review of Neuroscience 24 (1): 551–600. March 2001. doi:10.1146/annurev.neuro.24.1.551. PMID 11283321. https://semanticscholar.org/paper/2c96e7e2b57ad0e78c003dc4458a49c4a08fcd6a.
- ↑ Bradshaw & Dennis (2010) p. 2.
- ↑ a b "The role of hormone receptors and GTP-regulatory proteins in membrane transduction". Nature 284 (5751): 17–22. March 1980. doi:10.1038/284017a0. PMID 6101906.
- ↑ "Periodic geophysical and biological signals as Zeitgeber and exogenous inducers in animal organisms". International Journal of Biometeorology 16 Suppl: 113–25. PMID 4621276.
- ↑ "Davis-1961 revisited. Signal transmission in the cochlear hair cell-nerve junction". Archives of Otolaryngology 101 (9): 528–35. September 1975. doi:10.1001/archotol.1975.00780380006002. PMID 169771.
- ↑ "The effect of N-acylglucosamines on the biosynthesis and secretion of insulin in the rat". The Biochemical Journal 154 (3): 701–7. March 1976. doi:10.1042/bj1540701. PMC 1172772. PMID 782447.
- ↑ "What does Halobacterium tell us about photoreception?". Biophysics of Structure and Mechanism 3 (1): 69–77. April 1977. doi:10.1007/BF00536457. PMID 857951.
- ↑ "Lipid synthesis: an indicator of antigen-induced signal transduction in antigen-binding cells". Journal of Immunology 122 (4): 1278–84. April 1979. PMID 376714.
- ↑ Steiner, L A (1996) Immunoglobulin evolution, 30 years on. Glycobiology 6, 649-656
- ↑ Wu, T T, Kabat, E A (1970) An analysis of the sequences of the variable regions of Bence Jones proteins and myeloma light chains and their implications for antibody complementarity. J. Exp. Med. 132: 211-250
- ↑ Sarma, V R, Silverton, E W, Davies, D R, Terry W D (1971) The three-dimensional structure at 6 A resolution of a human gamma G1 immunoglobulin molecule, J Biol. Chem. 246 (11) 3752- 9
- ↑ Burnet, F M (1976) A modification of Jerne's theory of antibody production using the concept of clonal selection. CA: A Cancer Journal for Clinicians 26 (2) 119–21
- ↑ Becker, K E, Ishizaka, T, Metzger, H, Ishizaka, K and Grimley, P M (1973) Surface IgE on Human Basophils during histamine release. J Exp med, 138, 394-408
- ↑ Fanger, M W, Hart, D A, Wells, J V, and Nisonoff, A J (1970) Requirement for cross-linkage in the stimulation of transformation of rabbit peripheral lymphocytes by antiglobulin reagents J. Immun., 105, 1484 - 92
- ↑ Klemm J D, Schreiber S L, Crabtree G R (1998) Ann. Rev. Immunol. Dimerization as a regulatory mechanism in signal transduction 16: 569-592
- ↑ Bell, G I (1974) Model for the binding of multivalent antigens to cells, Nature Lond. 248, 430
- ↑ DeLisi, C and Perelson A (1976). The kinetics of aggregation phenomena, J. theor. Biol. 62, 159-210
- ↑ Dembo, M and Goldstein, B (1978) Theory of equilibrium binding of symmetric bivalent haptens to cell surface antibody: application to histamine release from basophils. The Journal of Immunology 121 (1), 345-353
- ↑ Sobotka, A.K. Dembo, M, Goldstein, B and Lichtenstein, L M, (1979) Antigen-specific desensitization of human basophils The Journal of Immunology, 122 (2) 511-517
- ↑ Kagey-Sobotka, A, Dembo, M, Goldstein, B, Metzger, H and Lichtenstein, L M (1981) Qualitative characteristics of histamine release from human basophils by covalently cross-linked IgE. The Journal of Immunology 127 (6), 2285-2291
- ↑ MacNab, R., and D. E. Koshland, Jr. (1972). The gradient-sensing mechanism in bacterial chemotaxis. Proc. Natl. Acad. Sci. U.S.A. 69:2509-2512
- ↑ Berg, H C and Purcell, E M (1977) Physics of chemoreception, Biophys. J 20(2):193-219
- ↑ Kirsten Jung, Florian Fabiani, Elisabeth Hoyer, and Jürgen Lassak 2018 Bacterial transmembrane signaling systems and their engineering for biosensing Open Biol. Apr; 8(4): 180023
Сыртқы сілтемелер
[өңдеу | қайнарын өңдеу]- Netpath - адамдардағы сигнал беру жолдарының таңдалған ресурсы Мұрағатталған 20 қыркүйектің 2012 жылы.
- Сигнал беру - биохимия, молекулалық биология және жасуша биологиясының виртуалды кітапханасы
- TRANSPATH(R) - сигналдарды тарату жолдары туралы мәліметтер базасы
- Science 's STKE - Signal Transduction Knowledge Environment, AAAS жариялаған Science журналынан.
- Signal+Transduction
- UCSD-Nature Signaling Gateway Мұрағатталған 12 ақпанның 2013 жылы., Nature Publishing Group компаниясынан
- LitInspector Мұрағатталған 11 мамырдың 2019 жылы. - PubMed рефераттарында сигнал беру жолын өндіру
- Хуасян Чен және т.б. Киназа сигнал беру жолдарын және дәрілік препараттардың тиімділігін бақылауға арналған жасуша негізіндегі иммуноцитохимиялық талдау (PDF) Мұрағатталған 22 ақпанның 2012 жылы. Analytical Biochemistry 338 (2005) 136-142
- www. Redoxsignaling.com
- Signaling PAthway дерекқоры Мұрағатталған 17 қыркүйектің 2012 жылы. - Кюсю университеті
- Жасуша циклі - Homo sapiens (адам) Мұрағатталған 23 қазанның 2012 жылы. - KEGG PATHWAY [1]
- Pathway Interaction Database - NCI
- Әдебиетпен таңдалған адам сигнализациясы желісі, ең үлкен адам сигнализация желісінің дерекқоры
