Киназа
Бұл мақала әлі тексерістен өтпеді. Тексерілмеген мақалалардағы мәліметтер сенімсіз болуы мүмкін.
|

Биохимияда киназа фосфат топтарының жоғары энергиялы фосфаттан молекулаларды белгілі бір субстраттарға беруді катализдейтін фермент. Бұл процесс фосфорлану деп аталады, онда жоғары энергиялы АТФ молекуласы субстрат молекуласына фосфат тобын береді. Бұл переэтерификация фосфорланған субстрат пен АДФ пайда болуына әкеледі. Керісінше, бұл фосфорланған субстрат фосфат тобын берген кезде дефосфорлану деп аталады, ал АДФ фосфат тобын алады (дефосфорланған субстрат пен жоғары энергиялы АТФ молекуласын құрайды). Бұл екі процесс, фосфорлану және дефосфорлану гликолиз кезінде төрт рет жүреді.[2][3][4]
Киназалар фосфотрансферазалардың үлкен тобына жатады. Киназаларды акцепторға бейорганикалық фосфат топтарының қосылуын катализдейтін фосфорилазалармен де, фосфат топтарын кетіретін фосфатазалармен де (дефосфорлану) шатастыруға болмайды. Молекуланың фосфорлану күйі, мейлі ол белок, липид немесе көмірсу болсын, оның белсенділігіне, реактивтілігіне және басқа молекулаларды байланыстыру қабілетіне әсер етуі мүмкін. Сондықтан киназалар метаболизмде, жасуша сигнализациясында, ақуызды реттеуде, жасушалық тасымалдауда, секреторлық процестерде және басқа да көптеген жасушалық жолдарда маңызды болып табылады, бұл оларды адам физиологиясы үшін өте маңызды етеді.
Биохимия және функционалдық өзектілігі[өңдеу | қайнарын өңдеу]
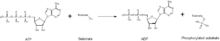
Киназалар фосфат бөлігінің жоғары энергиялы молекуладан (мысалы, AТФ) олардың субстрат молекуласына ауысуына делдал болады, төмендегі суретте көрінеді. Бұл реакцияны тұрақтандыру үшін киназалар қажет, өйткені фосфоангидридтік байланыс жоғары деңгейде энергияны қамтиды. Киназалар өздерінің субстраттары мен фосфорил тобын белсенді учаскелерінде дұрыс бағыттайды, бұл реакция жылдамдығын арттырады. Сонымен қатар, олар әдетте теріс зарядталған фосфат топтарымен әрекеттесу арқылы өтпелі күйді электростатикалық тұрақтандыратын оң зарядталған аминқышқылдарының қалдықтарын пайдаланады. Сонымен қатар, кейбір киназалар фосфат топтарын үйлестіру үшін белсенді учаскелерінде байланысқан металл кофакторларын пайдаланады. Протеинкиназаларды каталитикалық белсенді (канондық) немесе псевдокиназалар ретінде жіктеуге болады, бұл АТФ-ны орналастыратын немесе гидролиздейтін бір немесе бірнеше каталитикалық аминқышқылдарының эволюциялық жоғалуын көрсетеді.[5] Дегенмен, сигнал беру нәтижелері және аурудың өзектілігі тұрғысынан киназалар да, псевдокиназалар да адам жасушаларындағы маңызды сигнал модуляторлары болып табылады, киназаларды өте маңызды дәрілік мақсатқа айналдырады.[6]
Киназалар сигналдарды беру және жасушалардағы күрделі процестерді реттеу үшін кеңінен қолданылады. Молекулалардың фосфорлануы олардың белсенділігін күшейтуі немесе тежеуі және басқа молекулалармен әрекеттесу қабілетін модуляциялауы мүмкін. Фосфорил топтарының қосылуы және жойылуы жасушаны бақылау құралымен қамтамасыз етеді, өйткені әртүрлі киназалар әртүрлі жағдайларға немесе сигналдарға жауап бере алады. Функцияның жоғалуына немесе артуына әкелетін киназалардағы мутациялар адамдарда қатерлі ісік[7] және ауру тудыруы мүмкін, соның ішінде лейкоздың және нейробластомалардың кейбір түрлерін, глиобластоманы,[8] спиноцеребеллярлық атаксияны (14 типті) агаммаглобулинемия және басқалар.[9]
Тарихы және классификациясы[өңдеу | қайнарын өңдеу]
АТФ көмегімен басқа ақуыздың фосфорлануын катализдейтін бірінші ақуызды 1954 жылы Евгений П.Кеннеди байқады, сол кезде ол казеиннің фосфорлануын катализдейтін бауыр ферментін сипаттады. 1956 жылы Эдмонд Х.Фишер және Эдвин Г.Кребс фосфорилаза а мен фосфорилаза b арасындағы өзара конверсия фосфорлану және дефосфорлану арқылы жүретінін анықтады.[10] Фосфорил тобын фосфорилаза(b) ауыстырып, оны фосфорилаза(а) айналдыратын киназа Фосфорилаза киназа деп аталды. Жылдар өткеннен кейін протеинкиназа А (ПКА) фосфорилаза киназасын фосфорландыратын киназа каскадының алғашқы мысалы анықталды. Сонымен қатар, ПКА гликоген синтазасын тежейтіні анықталды, бұл тежелуге әкелетін фосфорлану оқиғасының алғашқы мысалы болды. 1969 жылы Лестер Рид пируватдегидрогеназаның фосфорлану арқылы инактивацияланғанын анықтады және бұл жаңалық фосфорланудың гликоген метаболизмінен басқа метаболизмдік жолдарда реттеу құралы ретінде қызмет етуі мүмкін екендігінің алғашқы анықтамасы болды. Сол жылы Том Ланган PKA гистон H1 фосфорланатынын анықтады, бұл фосфорлану ферментативті емес ақуыздарды реттей алады деп болжайды. 1970-ші жылдар кальмодулинге тәуелді протеинкиназалардың ашылуын және белоктардың бірнеше аминқышқылдарының қалдықтарында фосфорлануы мүмкін екендігін анықтауды қамтиды. 1990 жылдарды «белок киназа каскадтарының онжылдығы» деп сипаттауға болады. Осы уақыт ішінде MAPK/ERK жолы, JAK киназалары (ақуыз тирозин киназдарының отбасы) және PIP3-тәуелді киназа каскады ашылды.[11]
Әсер ететін субстрат бойынша киназалар кең топтарға жіктеледі: белоккиназалар, липидті киназалар, көмірсу киназалары. Киназаларды бактериялардан зеңге, құрттарға, сүтқоректілерге дейін әртүрлі түрлерде табуға болады.[12] Адамдарда бес жүзден астам әртүрлі киназалар анықталды. [2] Олардың әртүрлілігі және сигнал берудегі рөлі оларды қызықты зерттеу объектісіне айналдырады. Әртүрлі басқа киназалар липидтер, көмірсулар, амин қышқылдары және нуклеотидтер сияқты шағын молекулаларға сигнал беру үшін немесе оларды метаболикалық жолдар үшін дайындау үшін әрекет етеді. Ерекше киназалар көбінесе субстраттарының атымен аталады. Протеинкиназаларда көбінесе бірнеше субстрат болады, ал белоктар бірнеше арнайы киназалар үшін субстрат ретінде қызмет ете алады. Осы себепті белоккиназалар олардың белсенділігін реттейтін нәрсеге байланысты аталады (яғни Кальмодулинге тәуелді протеинкиназалар). Кейде олар бірнеше изоферменттік формалар болғандықтан одан әрі категорияларға бөлінеді. Мысалы, I және II типті циклдік-АМФ-тәуелді протеинкиназалар бірдей каталитикалық суббірліктерге ие, бірақ циклдік AMФ-ті байланыстыратын әртүрлі реттеуші суббірліктерге ие.[13]
Протеин киназалары[өңдеу | қайнарын өңдеу]

Протеинкиназалар белоктарға олардың серин, треонин, тирозин немесе гистидин қалдықтарында фосфорлану арқылы әсер етеді. Фосфорлану ақуыздың қызметін көптеген жолдармен өзгерте алады. Ол ақуыздың белсенділігін арттырады немесе азайтады, оны тұрақтандырады немесе жойылуын белгілейді, оны белгілі бір жасушалық бөлімшеде орналастырады және оның басқа ақуыздармен әрекеттесуін бастауы немесе бұзуы мүмкін. Протеин киназалары барлық киназалардың көпшілігін құрайды және кеңінен зерттеледі.[14] Бұл киназалар фосфатазалармен бірге ақуыздар мен ферменттерді реттеуде, сондай-ақ жасушада сигнал беруде маңызды рөл атқарады.
Жасушаның биологиялық реттеуге қол жеткізуінің әртүрлі жолдары туралы ойлау кезінде жалпы шатасу нүктесі туындайды. Жасушалық белоктар өтуі мүмкін коваленттік модификациялардың сансыз мысалдары бар; дегенмен, фосфорлану бірнеше қайтымды коваленттік модификациялардың бірі болып табылады. Бұл белоктардың фосфорлануының реттеуші екендігін дәлелдеді. Аллостериялық бақылаумен қамтамасыз етілген реттеуге қосымша белокты ковалентті түрлендірудің көптеген жолдары бар екенін ескерсек, ақуыз функциясын реттеудің әлеуеті орасан зор. Эдвин Кребс өзінің Хопкинс мемориалдық лекциясында аллостериялық бақылау жасушаның ішінен пайда болатын сигналдарға жауап беру үшін дамығанын, ал фосфорлану жасушадан тыс сигналдарға жауап беру үшін дамығанын айтты. Бұл идея прокариот жасушаларымен салыстырғанда белоктардың фосфорлануы эукариот жасушаларында жиірек болатындығына сәйкес келеді, өйткені неғұрлым күрделі жасуша түрі сигналдардың кең ауқымына жауап беру үшін дамыды.[13]
Циклинге тәуелді киназалар[өңдеу | қайнарын өңдеу]
Циклинге тәуелді киназалар (CDKs) - жасушалық циклді реттеуге қатысатын бірнеше түрлі киназалар тобы. Олар серин немесе треонин қалдықтарында басқа ақуыздарды фосфорлайды, бірақ CDK белсенді болу үшін алдымен циклин ақуызымен байланысуы керек.[15] Арнайы CDK және циклиндердің әртүрлі комбинациялары жасушалық циклдің әртүрлі бөліктерін белгілейді. Сонымен қатар, CDK-тердің фосфорлану күйі олардың белсенділігі үшін де маңызды, өйткені олар басқа киназалармен (мысалы, CDK-белсендендіруші киназа) және фосфатазалармен (Cdc25 сияқты) реттеледі. CDK белсенді болғаннан кейін, олардың белсенділігін өзгерту үшін басқа ақуыздарды фосфорлайды, бұл жасушалық циклдің келесі кезеңіне қажетті оқиғаларға әкеледі. Олар жасушалық циклды бақылаудағы қызметімен танымал болғанымен, CDK-тер транскрипцияда, метаболизмде және басқа жасушалық оқиғаларда рөлдерге ие.[16]
Олардың жасушалық бөлінуді басқарудағы негізгі рөліне байланысты CDK-дегі мутациялар көбінесе қатерлі ісік клеткаларында кездеседі. Бұл мутациялар жасушалардың бақылаусыз өсуіне әкеледі, өйткені олар бүкіл жасуша циклынан тез өтеді.[17] CDK мутациялары лимфомаларда, сүт безінің қатерлі ісігінде, ұйқы безінің ісіктерінде және өкпенің қатерлі ісігінде кездеседі. Сондықтан, CDK ингибиторлары ісіктің кейбір түрлерін емдеу ретінде әзірленді.[17]
Митогенмен белсендірілген протеинкиназалар[өңдеу | қайнарын өңдеу]
MAP киназалары (Mitogen-activated protein kinase MAPKs) - әртүрлі жасушадан тыс өсу сигналдарына жауап беретін серин/треонинкиназалар тобы. Мысалы, өсу гормоны, эпидермистің өсу факторы, тромбоциттерден алынған өсу факторы және инсулин барлығы MAPK жолына қатыса алатын митогендік ынталандырулар болып саналады. Бұл жолды рецепторлар деңгейінде белсендіру сигналдық каскадты бастайды, соның арқасында Ras GTPase гуанозиндифосфат GTP -ге ауыстырады. Содан кейін Рас MEK (MAPKK) белсендіретін Раф киназаны (MAPKKK деп те аталады) белсендіреді. MEK транскрипция мен аударманы реттей алатын MAPK (ERK деп те белгілі) белсендіреді. RAF және MAPK екеуі де серин/треонинкиназалар болса, MAPKK тирозин/треонинкиназа болып табылады.

MAPK транскрипция факторларын тікелей немесе жанама реттей алады. Оның негізгі транскрипциялық мақсаттарына ATF-2, Chop, c-Jun, c-Myc, DPC4, Elk-1, Ets1, Max, MEF2C, NFAT4, Sap1a, STATs, Tal, p53, CREB және Myc кіреді. MAPK сонымен қатар үлкен рибосомалық суббірлікте S6 киназасын фосфорлау арқылы трансляцияны реттей алады. Ол сондай-ақ Ras, Sos және EGF рецепторының өзін қоса алғанда, MAPK сигналдық каскадының жоғарғы бөлігіндегі компоненттерді фосфорлайды.[18]
MAPK жолының канцерогендік потенциалы оны клиникалық маңызды етеді. Ол бақыланбайтын өсуге және кейіннен ісіктің пайда болуына әкелуі мүмкін жасушалық процестерге қатысады. Осы жолдағы мутациялар оның жасушалардың дифференциациясына, пролиферациясына, өмір сүруіне және апоптозға реттеуші әсерін өзгертеді, олардың барлығы қатерлі ісіктің әртүрлі формаларына қатысты.[18]
Липидті киназалар[өңдеу | қайнарын өңдеу]
Липидкиназалар жасушадағы липидтерді плазмалық мембранада да, органеллалардың мембраналарында да фосфорлайды. Фосфат топтарының қосылуы липидтің реактивтілігі мен локализациясын өзгерте алады және сигнал беруде қолданылуы мүмкін.
Фосфатидилинозитолкиназалар[өңдеу | қайнарын өңдеу]

Киназа ферменттері инозитол гидроксил тобын нуклеофильді ету арқылы реакциялардың жылдамдығын арттырады, көбінесе амин қышқылы қалдығының бүйірлік тізбегін жалпы негіз ретінде әрекет ету және гидроксилді депротонациялау үшін пайдаланады, бұл төмендегі механизмде көрінеді. [19] Мұнда аденозинтрифосфат (АТФ) мен фосфатидилинозит арасындағы реакция үйлестірілген. Ақырғы нәтиже фосфатидилинозитол-3-фосфат, сондай-ақ аденозиндифосфат (АДФ) болып табылады. Сондай-ақ ферменттер реакцияның жылдам жүруі үшін АТФ молекуласын, сондай-ақ инозитол тобын дұрыс бағыттауға көмектеседі. Осы мақсат үшін жиі металл иондары үйлестіріледі. [19]

Сфингозинкиназалар[өңдеу | қайнарын өңдеу]
Сфингозинкиназа (SK) - сфингозиннің сфингозин-1-фосфатқа (S1P) айналуын катализдейтін липидтікиназа. Сфинголипидтер - барлық жерде орналасқан мембраналық липидтер. Белсендірілгеннен кейін сфингозинкиназа цитозолдан плазмалық мембранаға ауысады, онда ол γ фосфатты (соңғы немесе соңғы фосфат) ATФ немесе GTP -ден сфингозинге тасымалдайды. S1P рецепторы GPCR рецепторы болып табылады, сондықтан S1P G ақуызының сигнализациясын реттеу мүмкіндігіне ие. Алынған сигнал ERKs, Rho GTPase, Rac GTPase, PLC және AKT/PI3K сияқты жасушаішілік эффекторларды белсендіре алады. Ол сондай-ақ жасуша ішіндегі мақсатты молекулаларға өз әсерін көрсете алады. S1P HDAC гистон деацетилаза белсенділігін тікелей тежейтіні көрсетілген. Керісінше, фосфорсыздандырылған сфингозин жасуша апоптозына ықпал етеді, сондықтан жасуша тағдырын анықтаудағы рөліне байланысты SK реттелуін түсіну өте маңызды. Өткен зерттеулер көрсеткендей, СК рак клеткаларының өсуін қамтамасыз ете алады, өйткені олар жасушалық пролиферацияға ықпал етеді және SK1 (СК-ның белгілі бір түрі) ісіктердің белгілі бір түрлерінде жоғары концентрацияда болады.
Сүтқоректілердің жасушаларында екі киназа бар, SK1 және SK2. SK1 SK2-мен салыстырғанда нақтырақ және олардың өрнек үлгілері де ерекшеленеді. SK1 өкпе, көкбауыр және лейкоцит жасушаларында, ал SK2 бүйрек және бауыр жасушаларында экспрессияланады. Бұл екі киназаның жасушаның тіршілігіне, пролиферациясына, дифференциациясына және қабынуына қатысуы оларды химиотерапиялық терапия үшін өміршең кандидаттар етеді. [20]
Көмірсу киназалары[өңдеу | қайнарын өңдеу]
Көптеген сүтқоректілер үшін көмірсулар күнделікті калориялық қажеттіліктің үлкен бөлігін қамтамасыз етеді. Олигосахаридтерден энергия жинау үшін алдымен олар метаболизмге түсуі үшін моносахаридтерге ыдырауы керек. Киназалар метаболизмнің барлық дерлік жолдарында маңызды рөл атқарады. Сол жақтағы суретте киназалармен катализделген екі маңызды реакция бар гликолиздің екінші фазасы көрсетілген. 1,3 бисфосфоглицераттағы ангидридті байланыс тұрақсыз және жоғары энергияға ие. 1,3-бисфосфогилцераткиназа 3-фосфоглицерат пен АТФ түзетін реакцияны жүзеге асыру үшін АДФ қажет. Гликолиздің соңғы сатысында пируваткиназа фосфорил тобын фосфоэнолпируваттан АДФ-ге ауыстырып, АТФ пен пируват түзеді.
Гексокиназа глюкозаны жасушаға алғаш кіргенде оны пайдаланатын ең көп таралған фермент болып табылады. Ол АТФ гамма фосфатын С6 позициясына ауыстыру арқылы D-глюкозаны глюкоза-6-фосфатқа айналдырады. Бұл гликолиздегі маңызды қадам, өйткені ол теріс зарядқа байланысты глюкозаны жасуша ішінде ұстайды. Глюкоза өзінің фосфорсызданған түрінде мембрана арқылы алға-артқа өте оңай жылжи алады.[21] Гексокиназа геніндегі мутациялар сфероцитарлы емес гемолитикалық анемияны тудыруы мүмкін гексокиназа тапшылығына әкелуі мүмкін.[22]
Фосфофруктокиназа немесе ФФК фруктоза-6-фосфаттың фруктоза-1,6-бисфосфатқа айналуын катализдейді және гликолизді реттеудегі маңызды нүкте болып табылады. ATФ, H+ және цитраттың жоғары деңгейлері ПФК тежейді. Егер цитрат деңгейі жоғары болса, бұл гликолиздің оңтайлы жылдамдықта жұмыс істейтінін білдіреді. АТФ жоғары деңгейлері ФФК ынталандырады. Таруи ауруы, жаттығуларға төзбеушілікке әкелетін гликогенді сақтау ауруы, оның белсенділігін төмендететін ФФК геніндегі мутацияға байланысты.[23]
Басқа киназалар[өңдеу | қайнарын өңдеу]
Киназалар белоктардан, липидтерден және көмірсулардан басқа көптеген басқа молекулаларға әсер етеді. Нуклеотидтерге (ДНҚ және РНҚ) әсер ететін көптеген заттар бар, соның ішінде нуклеозид-фосфаткиназалар және нуклеозид-дифосфаткиназалар сияқты нуклеотидтердің өзара конверсиясына қатысатындар.[25] Киназалардың субстраты болып табылатын басқа шағын молекулаларға креатин, фосфоглицерат, рибофлавин, дигидроксиацетон, шикимат және басқалары жатады.
Рибофлавинкиназа[өңдеу | қайнарын өңдеу]
Рибофлавинкиназа флавин мононуклеотиді (FMN) түзу үшін рибофлавиннің фосфорлануын катализдейді. Оның реттелген байланысу механизмі бар, онда рибофлавин АТФ молекуласымен байланыспас бұрын киназамен байланысуы керек.[26] Екі валентті катиондар нуклеотидті үйлестіруге көмектеседі.[26] Жалпы механизм төмендегі суретте көрсетілген.

Рибофлавинкиназа жасушаларда маңызды рөл атқарады, өйткені FMN маңызды кофактор болып табылады. FMN сонымен қатар көптеген ферменттер, соның ішінде метаболизмде көптеген ферменттер пайдаланатын тотығу- тотықсыздандырғыш кофакторы болып табылатын флавин адениндинуклеотидінің (ФАД) прекурсоры болып табылады. Шындығында, рибофлавиннің FMN -ге фосфорлануын, сондай-ақ FMN -ден FAD реакциясын жүргізуге қабілетті кейбір ферменттер бар.[27] Рибофлавинкиназа инсульттің алдын алуға көмектеседі және болашақта емдеу ретінде қолданылуы мүмкін. [28] Ол тышқандарда зерттелген кезде инфекцияға да қатысты.[29]
Тимидинкиназа[өңдеу | қайнарын өңдеу]
Тимидинкиназа - нуклеозидтердің фосфорлануына жауап беретін көптеген нуклеозидкиназалардың бірі. Тимидин монофосфатын (dTMP) жасау үшін тимидинді фосфорлайды. Бұл киназа төменде көрсетілгендей тимидинге фосфат беру үшін ATP молекуласын пайдаланады. Тимидинкиназа, сондай-ақ басқа нуклеозидтер мен нуклеотид киназалары арқылы фосфаттың бір нуклеотидтен екіншісіне тасымалдануы әртүрлі нуклеотидтердің әрқайсысының деңгейін бақылауға көмектесу үшін қызмет етеді.

dTMP молекуласын жасағаннан кейін, басқа киназа, тимидилаткиназа, дифосфатты пішінді dTDP жасау үшін dTMP-ге әсер ете алады. Нуклеозиддифосфаткиназа ДНҚ синтезінде қолданылатын тимидинтрифосфат, dTTP түзілуін катализдейді. Осыған байланысты тимидинкиназа белсенділігі жасушалық циклмен тығыз байланысты және клиникалық химияда ісік маркері ретінде қолданылады.[30] Сондықтан оны кейде науқастың болжамын болжау үшін қолдануға болады.[31] Тимидинкиназа генінің мутациялары бар науқастарда митохондриялық ДНҚ -ны жоғалту синдромының белгілі бір түрі болуы мүмкін, бұл ауру ерте балалық шақта өлімге әкеледі.[32]
Сондай-ақ қараңыз[өңдеу | қайнарын өңдеу]
- Белсендіру циклі
- Автофосфорлану
- СаmwAWg2+кальмодулинге тәуелді протеинкиназа
- Жасуша сигнализациясы
- Циклинге тәуелді киназа
- G белокпен байланысқан рецептор
- Нуклеозид-дифосфаткиназа
- Фосфатаза
- Фосфатидилинозитолфосфаткиназалар
- Фосфолипид
- Фосфопротеин
- Фосфорлану
- Фосфотрансфераза
- Сигналдың берілуі
- Тимидинкиназа
- Клиникалық химиядағы тимидинкиназа
- Тимидилаткиназа
- Қабырғамен байланысты киназа
Дереккөздер[өңдеу | қайнарын өңдеу]
- ↑ "Crystal structure of the Citrobacter freundii dihydroxyacetone kinase reveals an eight-stranded alpha-helical barrel ATP-binding domain". The Journal of Biological Chemistry 278 (48): 48236–48244. November 2003. doi:10.1074/jbc.M305942200. PMID 12966101.
- ↑ a b "The protein kinase complement of the human genome". Science 298 (5600): 1912–1934. December 2002. Bibcode 2002Sci...298.1912M. doi:10.1126/science.1075762. PMID 12471243. Дереккөз қатесі: Invalid
<ref>tag; name "pmid12471243" defined multiple times with different content - ↑ Kinase. TheFreeDictionary.com
- ↑ Kinase. TheFreeDictionary.com
- ↑ "Day of the dead: pseudokinases and pseudophosphatases in physiology and disease". Trends in Cell Biology 24 (9): 489–505. September 2014. doi:10.1016/j.tcb.2014.03.008. PMID 24818526.
- ↑ Foulkes DM, Byrne DP and Eyers PA (2017) Pseudokinases: update on their functions and evaluation as new drug targets. Future Med Chem. 9(2):245-265
- ↑ Hallmarks of Cancer 1.
- ↑ Mutational profiling of kinases in glioblastoma.
- ↑ Kinase mutations in human disease: interpreting genotype-phenotype relationships.
- ↑ "Historical perspectives on protein phosphorylation and a classification system for protein kinases". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 302 (1108): 3–11. July 1983. Bibcode 1983RSPTB.302....3K. doi:10.1098/rstb.1983.0033. PMID 6137005.
- ↑ "The role of human herpesvirus 8 and Epstein-Barr virus in the pathogenesis of giant lymph node hyperplasia (Castleman's disease)". Clinical Infectious Diseases 22 (6): 1120–1121. June 1996. doi:10.1093/clinids/22.6.1120. PMID 8783733.
- ↑ "Structural evolution of the protein kinase-like superfamily". PLOS Computational Biology 1 (5): e49. October 2005. Bibcode 2005PLSCB...1...49S. doi:10.1371/journal.pcbi.0010049. PMC 1261164. PMID 16244704.
- ↑ a b "The phosphorylation of proteins: a major mechanism for biological regulation. Fourteenth Sir Frederick Gowland Hopkins memorial lecture". Biochemical Society Transactions 13 (5): 813–820. October 1985. doi:10.1042/bst0130813. PMID 2998902. Дереккөз қатесі: Invalid
<ref>tag; name "krebs lec" defined multiple times with different content - ↑ "The protein kinase complement of the human genome". Science 298 (5600): 1912–1934. December 2002. Bibcode 2002Sci...298.1912M. doi:10.1126/science.1075762. PMID 12471243.
- ↑ "Cyclin-dependent kinases". Chemical Reviews 101 (8): 2511–2526. August 2001. doi:10.1021/cr0001030. PMID 11749386.
- ↑ "Cdks, cyclins and CKIs: roles beyond cell cycle regulation". Development 140 (15): 3079–3093. August 2013. doi:10.1242/dev.091744. PMID 23861057.
- ↑ a b "Cyclin dependent kinases in cancer: potential for therapeutic intervention". Cancer Biology & Therapy 13 (7): 451–457. May 2012. doi:10.4161/cbt.19589. PMID 22361734.
- ↑ a b Organization and regulation of mitogen-activated protein kinase signaling pathways. Дереккөз қатесі: Invalid
<ref>tag; name "MAPK" defined multiple times with different content - ↑ a b c "Shaping development of autophagy inhibitors with the structure of the lipid kinase Vps34". Science 327 (5973): 1638–1642. March 2010. Bibcode 2010Sci...327.1638M. doi:10.1126/science.1184429. PMC 2860105. PMID 20339072. Дереккөз қатесі: Invalid
<ref>tag; name "PI" defined multiple times with different content - ↑ "Roles, regulation and inhibitors of sphingosine kinase 2". The FEBS Journal 280 (21): 5317–5336. November 2013. doi:10.1111/febs.12314. PMID 23638983.
- ↑ "Metabolic regulation by chemical modification of enzymes". Annual Review of Biochemistry 40: 345–374. doi:10.1146/annurev.bi.40.070171.002021. PMID 4399446.
- ↑ Nonspherocytic hemolytic anemia due to hexokinase deficiency.
- ↑ Phosphofructokinase Deficiency Glycogen Storage Disease.
- ↑ "Crystal structure of Schizosaccharomyces pombe riboflavin kinase reveals a novel ATP and riboflavin-binding fold". Journal of Molecular Biology 326 (5): 1463–1473. March 2003. doi:10.1016/s0022-2836(03)00059-7. PMID 12595258.
- ↑ {{{тақырыбы}}}. — ISBN 9780470129302.
- ↑ a b "Ligand binding-induced conformational changes in riboflavin kinase: structural basis for the ordered mechanism". Biochemistry 42 (43): 12532–12538. November 2003. doi:10.1021/bi035450t. PMID 14580199.
- ↑ "Over-expression in Escherichia coli, purification and characterization of isoform 2 of human FAD synthetase". Protein Expression and Purification 52 (1): 175–181. March 2007. doi:10.1016/j.pep.2006.09.002. PMID 17049878.
- ↑ "Importance of riboflavin kinase in the pathogenesis of stroke". CNS Neuroscience & Therapeutics 18 (10): 834–840. October 2012. doi:10.1111/j.1755-5949.2012.00379.x. PMC 6493343. PMID 22925047.
- ↑ "Flavin metabolism during respiratory infection in mice". The British Journal of Nutrition 76 (3): 453–462. September 1996. doi:10.1079/BJN19960050. PMID 8881717.
- ↑ "Thymidine kinase and cancer monitoring". Cancer Letters 316 (1): 6–10. March 2012. doi:10.1016/j.canlet.2011.10.025. PMID 22068047.
- ↑ "The role of thymidine kinase in cancer diseases". Expert Opinion on Medical Diagnostics 2 (2): 129–141. February 2008. doi:10.1517/17530059.2.2.129. PMID 23485133.
- ↑ "Thymidine kinase 2 defects can cause multi-tissue mtDNA depletion syndrome". Brain 131 (Pt 11): 2841–2850. November 2008. doi:10.1093/brain/awn236. PMID 18819985.
